Diagnostik des Vitamin-B12-Mangels
Vitamin B12 ist ein essentielles Vitamin für die DNA-Synthese, die Bildung und den Erhalt der Myelinscheiden, die Synthese von Neurotransmittern und die Erythropoese. Der Vitamin-B12-Stoffwechsel ist eng an den Stoffwechsel der Folsäure gebunden.
Physiologie
Vitamin B12 (Cobalamin) wird im Darmlumen des distalen Ileums an den Intrinsic Faktor gebunden und über spezielle Rezeptoren der Darmschleimhaut aufgenommen. Im Plasma erfolgt anschließend die Bindung von Vitamin B12 an Transcobalamin. Diese Verbindung wird als Holotranscobalamin (HoloTC) bezeichnet und stellt das metabolisch aktive Vitamin B12 dar. Der weitaus größere Rest (70-90 %) wird an das Protein Haptocorrin gebunden. Dieser Komplex gilt als biologisch inaktive Verbindung, da mit Ausnahme der Leberzellen keine anderen Körperzellen über spezifische Rezeptoren zur Aufnahme verfügen.
Nur Holotranscobalamin (HoloTC) kann als aktive Form des Vitamin B12 von allen Zellen über entsprechende Rezeptoren aufgenommen werden.
Bei der herkömmlichen Bestimmungsmethode des Vitamin B12 wird zwischen metabolisch aktiver und inaktiver Form nicht unterschieden. Daher kann insbesondere im unteren Drittel des Referenzintervalls von Gesamt-Vitamin B12 bereits ein biologisch wirksamer Mangel an HoloTC vorliegen, der nicht erkannt wird.
Die alleinige Messung und Betrachtung des Gesamt-Vitamin B12 gibt somit, insbesondere bei Werten < 350 pg/ml, keine zuverlässige Auskunft darüber, ob den Zellen HoloTC in ausreichender Menge zur Verfügung steht.
Neben der Messung des HoloTC hat sich die Bestimmung von Homocystein und Methyl-Malonsäure (MMA) als diagnostisch sinnvoll erwiesen. Da Vitamin B12 essentieller Kofaktor im Methionin-/Homocysteinstoffwechsel ist, steigen bei intrazellulärem Vitamin B12-Mangel die Konzentrationen an Homocystein und MMA an. Die Messung von HoloTC, Homocystein und MMA hat in großen klinischen Studien eine weitaus höhere Sensitivität und Spezifität ergeben als die alleinige Messung des Gesamt-Vitamin-B12-Spiegels.
Weiterführend konnte gezeigt werden, dass Zeichen eines klinischen Vitamin-B12-Mangels bei Personen mit VitaminB12-Spiegeln im Referenzbereich (> 191 pg/ml) auftreten können und dass Personen mit normalen Vitamin-B12- Spiegeln bereits erniedrigte HoloTC-Spiegel (< 35 pmol/l) und erhöhte MMA-Konzentrationen (> 32 µg/l) als Ausdruck eines intrazellulären, metabolisch manifesten Vitamin-B12- Mangels aufweisen können.
Zusammenfassend gilt, dass ein isoliert erniedrigtes HoloTC bereits die Entleerung der Vitamin-B12-Speicher anzeigt (negative Vitamin-B12-Bilanz), während erniedrigtes HoloTC plus erhöhtes Homocystein und MMA indikativ sind für einen metabolisch manifesten Vitamin-B12-Mangel.
Klinische Bedeutung
Ein Vitamin B12-Mangel hat drei klinische Manifestationen: die megaloblastäre Anämie (hämatologisch), chronische atrophische Gastritis und neuropsychiatrische Erkrankungen (z. B. Polyneuropathien, Gedächtnisstörungen, Demenz, Depression). Der Mangel zieht sich durch alle Altersgruppen mit Häufungen im Alter, bei Vegetariern und Veganern sowie bei chronisch Kranken. Die makrozytäre Anämie gilt als später Indikator eines Vitamin-B12-Mangels. Die neuro-psychiatrischen Symptome gehen den Blutbildveränderungen in der Regel voraus und können auftreten, bevor die Vitamin-B12-Konzentration den unteren Referenzbereich unterschreitet.
Eine frühzeitige Diagnostik erlaubt therapeutische Schritte zu einem Zeitpunkt, zu dem etwaige neurologische Schä- digungen noch reversibel sein können. Der Therapieerfolg sollte durch die Bestimmung von Gesamt-Vitamin-B12 bzw. HoloTC und ggf. zusätzlich durch die Bestimmung von Homocystein und MMA kontrolliert werden.
Vitamin B12 Malabsorption
1. Intrinsic Factor Mangel
Der Mangel an Intrinsic-Faktor (IF), ein Glykoprotein, das für die Bindung und Resorption von Vitamin B12 verantwortlich ist, zählt zu den häufigsten Ursachen einer Vitamin B12- Malabsorption. Verursacht wird der IF-Mangel durch Autoantikörper (AAk) gegen Parietalzellen (PC) und gegen den Intrinsic-Faktor. In Folge kommt es zur Ausprägung einer chronisch-atrophischen Gastritis vom Typ A (Autoimmungastritis) mit nachfolgender Entwicklung einer perniziösen Anämie. PC-AAk sind in nahezu allen Fällen einer Autoimmungastritis und bei 80-100 % der Patienten mit einer perniziösen Anämie nachweisbar. Die IF-AAk finden sich bei ca. 50-70 % dieser Autoimmunerkrankungen. Während die PCAAk eine eingeschränkte Sensitivität vorweisen, da sie auch bei anderen Krankheitsbildern (z. B. Typ 1-Diabetes, Hashimoto-Thyreoiditis) und Gesunden (5-10 %) nachweisbar sind, gelten die IF-AAk als hochspezifisch für die Autoimmungastritis und den damit assoziierten Vitamin B12-Mangelsyndromen (perniziöse Anämie, funikuläre Myelose). Es empfiehlt sich immer die gleichzeitige Untersuchung beider AAk, da der gemeinsame AAk-Nachweis die diagnostische Aussagekraft erhöht.
2. Helicobacter pylori-Infektion
Die Abspaltung von Vitamin B12 aus der Nahrung erfordert einen niedrigen pH-Wert. Demzufolge können Zustände und Erkrankungen, die die gastrointestinale Säureproduktion beeinflussen, zu einem Vitamin B12-Mangel durch Malabsorption führen. Dazu gehören z. B. Infektionen mit Helicobacter pylori. In Studien wurde bei 56 % der Patienten mit Vitamin B12-Mangel eine Helicobacter-Infektion nachgewiesen. Nach gezielter antibiotischer Therapie konnte in über 40 % der Fälle ein Anstieg des Vitamin B12-Spiegels und des HoloTC nachgewiesen werden.
Auch die Einnahme von Protonenpumpenhemmern oder Histamin-H2-Rezeptorblockern über einen längeren Zeitraum hinweg können über diesen Mechanismus zu einem Vitamin B12-Mangel führen.
Indikation
Ein Vitamin B12-Mangel entwickelt sich über verschiedene Stadien hinweg, von der Speicherentleerung über einen metabolisch-funktionellen Mangel bis hin zur klinischen Manifestation. Da der Körper eine hohe Speicherkapazität für Vitamin B12 aufweist, kann eine Unterversorgung erst nach ein paar Jahren klinisch auffällig werden. Für eine frühzeitige Diagnose empfiehlt sich eine regelmäßige Überprüfung des Vitamin B12-Spiegels bei Risikogruppen mit hoher B12- Mangel-Frequenz. Zu diesen Risikogruppen zählen:
- ältere Menschen
- Vegetarier, Veganer
- Frauen in der Schwangerschaft und Stillzeit
- Personen mit Resorptionsstörungen (Pankreasinsuffizienz, Erkrankungen des terminalen Ileums, chronischatrophische Gastritis, Wurmbefall)
- Patienten mit ungeklärter Anämie
- chronisch kranke Patienten (Leber- und Nierenerkrankungen, HIV-Infektion, Malignome)
- Patienten mit neuropsychiatrischen Symptomen (z. B. Neuropathien, Demenz, Alzheimer)
- chronischer Alkoholismus
- Medikamente (z. B. Protonenpumpenhemmer, H2- Rezeptor-Antagonisten)
Wo ist Vitamin B12 enthalten?
Vitamin B12-reich sind vor allem tierische Lebensmittel wie Leber, Fleisch, Fisch, Milch, Käse und Eier. Pflanzen enthalten kaum Vitamin B12.
Labordiagnostik
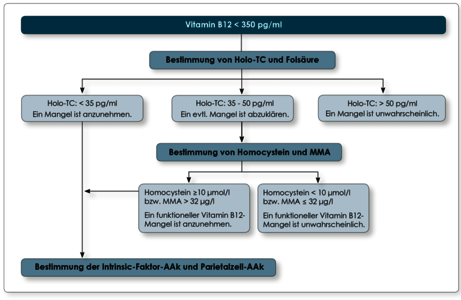
Bei Verdacht auf einen Vitamin B12-Mangel empfiehlt sich das nachfolgend aufgeführte diagnostische Vorgehen (Abb.).
Achtung: Bei Patienten mit chronischen Nierenerkrankungen ist die Verwendbarkeit der Serumspiegel von Vitamin B12 und HoloTC nur eingeschränkt möglich. Bei diesen Patienten reflektiert der im Serum gemessene Wert häufig nicht den funktionellen Vitamin B12 Status; der Vitamin B12 Mangel wird hier über die Reduktion der MMA-Konzentration durch Cobalamingabe bestätigt
Material und Präanalytik
1 Serum-Röhrchen (Gesamt-Vitamin B12, HoloTC, MMA, Parietalzell-/Intrinsic-Faktor-AAk)
1 Röhrchen saures Citrat-Plasma (Homocystein)
Zur Patientenvorbereitung sind keine besonderen Maßnahmen erforderlich. Die Blutprobe sollte spätestens am Folgetag im Labor eintreffen. Hämolytische Proben beeinflussen das Testergebnis und sollten nicht verwendet werden.
Abrechnung
Die Abrechnung ist für alle Parameter im kassen- und privatärztlichen Bereich gegeben.
Literatur
- Nilsson K et al. Clin Chem Lab Med. 2004; 42(6): 637-643
- Herrmann W et al. Curr Drug Metab. 2005; 6(1): 47-53
- Clarke R et al. Clin Chem. 2007; 53(5): 963-70
- Thomas L et al. Labor und Diagnose, 8. Auflage 2012
- Heinzl S. Dtsch Arztebl 2014; 111(9): A-353 / B-307 / C-294