/fachinformationen/diagnostikinformationen/genetik-der-entgiftung
Genetik der Entgiftung (Toxikogenetik)
Ungünstige genetische Ausstattungen des Entgiftungssystems können nicht nur unerwünschte Arzneimittelwirkungen hervorrufen, sondern sind vor allem für erhebliche interindividuelle Unterschiede im Fremdstoffmetabolismus verantwortlich. Genetische Variationen in den Schlüsselenzymen der Entgiftung können daher die Entwicklung verschiedener Erkrankungen fördern. Dazu gehören Migräne, chronisches Erschöpfungssyndrom (CFS), multiple Chemikalien Sensitivität (MCS), Tumore, Rheuma, Alzheimer und andere chronische Erkrankungen.
Entgiftung von Fremdstoffen
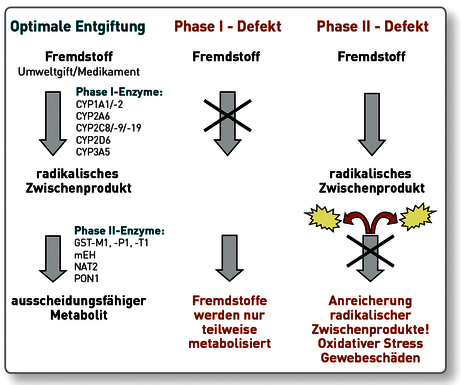
Bedingt durch fortschreitende Entwicklungen der pharmazeutischen Industrie, aber auch durch eine höhere Schadstoffbelastung der Umwelt ist der menschliche Organismus einer immer größer werdenden Menge an Medikamenten und Fremdstoffen ausgesetzt. Diese müssen von den Entgiftungsenzymen des Körpers (vor allem in der Leber) metabolisiert werden. Die exogenen Fremdstoffe sind meist lipophil, so dass sie ohne weitere Modifikation nicht ausgeschieden werden können. Dem menschlichen Organismus steht für den Metabolismus dieser Substanzen eine spezifische Enzymausstattung zur Verfügung, die die Neutralisierung und somit die Umwandlung in ausscheidungsfähige Endprodukte ermöglicht. Dieser Entgiftungsprozess läuft überwiegend in zwei Phasen ab.
Verminderter Phase I-Metabolismus führt zu verminderter Entgiftung der Ausgangsprodukte. Eine induzierte Phase I-Metabolisierung hingegen reichert radikale Zwischenprodukte an, was vor allem klinisch relevant ist, wenn diese nicht optimal in Phase II weiter verstoffwechselt werden.
In der Phase I werden toxische Substanzen mittels verschiedener Cytochrom P450-Enzyme reduziert, hydrolysiert und oxidiert. Die Produkte der Phase I sind zumeist aggressiver als das primäre Toxin, so dass die schnelle Entgiftung bzw. Ausscheidung in der Phase II essentiell ist.
In der Phase II werden daher polare hydrophile Moleküle wie Glutathion, Acetat, Cystein, Sulfat, Glycin oder Glucuronat an die Metaboliten der Phase I angelagert, wodurch diese dann in wasserlöslicher Form für die biliäre bzw. renale Ausscheidung zur Verfügung stehen.
Die individuelle Entgiftungskapazität entscheidet über die Toxizität von Substanzen
Die Effektivität der Metabolisierung von Arzneimitteln und Fremdstoffen ist von einem optimalen Zusammenspiel der am Entgiftungsprozess beteiligten Enzyme abhängig. Genetische Varianten (so genannte Polymorphismen) der Entgiftungsenzyme können einen Einfluss auf die Funktionalität des entsprechenden Enzyms und somit auf seine Substrat-umsatzgeschwindigkeit haben. Betroffene Personen reagieren anders auf Umweltgifte. Unverträglichkeiten gegenüber Schadstoffen oder oxidativer Stress sind die Folge. In Bezug auf die Verstoffwechselung von Medikamenten können z.B. unerwünschte Arzneimittelwirkungen oder eine fehlende therapeutische Wirkung auftreten.
Durch Gentests können diese „Schwachstellen“ in den Entgiftungsenzymen nachgewiesen werden und durch die Vermeidung entsprechender Belastungen sowie adäquate Ernährungsstrategien kann ein Ausgleich erfolgen.
Phase I - Cytochrom P450 (CYP450)-Enzyme
CYP1A1 spielt eine entscheidende Rolle bei der Entgiftung von Benz(a)pyren und polyzyklischen Aromaten. Diese Substanzen treten in großen Mengen beim Rauchen, beim Braten von rotem Fleisch, bei chemischen Herstellungsprozessen sowie bei der Kraftstoffverbrennung auf und sind in organischen Lösungsmitteln, künstlichen Farbstoffen, Pestiziden und Lacken enthalten. Eine genetische Variante führt zu einer induzierten Enzymaktivität.
CYP1A2 katalysiert den Abbau aromatischer und heterozyklischer Amine, die im Tabakrauch enthalten sind, für die Synthese von Farbstoffen und Pestiziden verwendet und als Pyrolyseprodukte von Nahrungsmitteln gebildet werden. Zudem verstoffwechselt es rund 5% der Arzneistoffe, wie z.B. Phenacetin, Paracetamol, Coffein, Theophyllin und Clozapin. Es gibt Genvarianten, die sowohl eine verminderte als auch eine deutlich induzierte CYP1A2-Aktivität bedingen.
CYP2A6 katalysiert vor allem die Phase-I-Metabolisierung der Dimethylnitrosamine, die in Lebensmitteln, insbesondere in gepökelten Räucherwaren sowie im Tabakrauch vorkommen. Dieses Enzym ist auch an der Biotransformation von Valproinsäure, Nicotin, Cotinin (Metabolit von Nicotin), Hexamethylphosphoramid (Prokarcinogen), 2,6-Dichlorobenzonitril (Herbizid), Nitrophenol und Cumarin (Pflanzenglycosid) beteiligt. Genetische Varianten führen zu einer verminderten Enzymaktivität.
CYP2C9 wurde erstmals bei Personen mit einer Tolbutamin-Unverträglichkeit identifiziert. Es metabolisiert aber neben einer Reihe weiterer bekannter Therapeutika (wie z.B. Phenytoin und Warfarin) auch Benz(a)pyren. Es gibt Genvariationen, die zu einer deutlich reduzierten Enzymaktivität führen.
CYP2D6 war 1992 das erste Phase I-Enzym, was genotypisiert wurde. Die bisher gefundenen Genveränderungen sind sehr variabel und reichen von Punktmutationen, Insertionen, Deletionen bis hin zum Auftreten von Genduplikationen. Der enzymatische Phänotyp kann sich daher in einer gänzlich fehlenden Enzymaktivität bis hin zur ultraschnellen Metabolisierung äußern. Rund 25 % aller handelsüblichen Pharmaka, vor allem Antidepressiva und Kardiaka, werden auf dem Hauptstoffwechselweg durch CYP2D6 metabolisiert.
CYP2C19 ist am Metabolismus verschiedener Antidepressiva, Antiepileptika, Protonenpumpenhemmer sowie beim Malariamittel Proguanil beteiligt. Darüber hinaus spielt es eine entscheidende Rolle bei der Bildung des aktiven Metaboliten von Clopidogrel. Es gibt Genvarianten, die einen Aktivitätsverlust des Enzyms sowie eine gesteigerte Enzymaktivität bedingen.
Phase II
Glutathion-S-Transferasen (GST) spielen eine Schlüsselrolle bei der zellulären Detoxifikation von Karzinogenen und Xenobiotika. Genvarianten in den Enzymen GST-M1, GST-T1 und GST-P1 führen zu einer schlechteren Entsorgung der äußerst radikalen Zwischenprodukte aus den Phase I-Reaktionen und vermitteln dadurch eine Disposition für Tumore, neurodegenerative Erkrankungen und Zustände, die mit oxidativem Stress assoziiert sind. Ausbleibende therapeutische Wirkungen von Medikamenten gehen damit ebenfalls einher. Wichtigste Substrate der GSTs sind Epoxide, Chinone, Alkylhalogenide, Benzylhalogenide und Stilben.
Während für GST-M1 und GST-T1 komplette Gendeletionen und somit komplette Aktivitätsverluste vorliegen können, ist für GST-P1 eine Genvariante bekannt, die eine substratveränderte Enzymaktivität zur Folge hat.
Die mikrosomale Epoxidhydrolase (mEH) wandelt aus der Phase I hervorgegangene hochreaktive Epoxide zu wasserlöslichen Derivaten um. Neben Fremdstoffen wie Acrylamid, Benzol, Styrol und Aflatoxin neutralisiert die mEH z.B. Carbamazepin, Phenytoin und Phenobarbiturate. Es gibt zwei funktionell relevante Punktmutationen im mEH-Gen, die je nach Vorhandensein zu vermehrter oder verminderter Aktivität der mEH führen und eine erhöhte Toxizität von Epoxid-bildenden Substanzen im Rahmen der Entgiftung bedingen können.
Verschiedene Varianten im N-Acetyltransferase 2 (NAT2)-Gen führen in der Phase II zum „langsamen Acetylierer“-Typ. Durch Anreicherung radikaler Phase I-Metabolite kann es zu toxischen Erscheinungen sowie zu klinisch relevanten unerwünschten medikamentösen Nebenwirkungen kommen, wie Hypersensitivität, Neuropathie oder Leukopenie. NAT2 wird in der Leber gebildet und bewirkt dort die Entgiftung von Benz(a)pyren, polyzyklischen Aromaten sowie Hydrazinen und ist zudem am Abbau von Aminosäuren beteiligt.
Die Paraoxonase 1 (PON1) hydrolysiert eine Vielzahl von Nervengiften wie Sarin, Soman sowie die toxischen Oxon-Metaboliten von verschiedenen Organophosphor-Insektiziden, wie Parathion (E605), Diazinon und Chlorpyrifos. PON1 hydrolysiert ebenfalls aromatische Ester (Phenylacetat, Thiophenylacetat und 2-Naphthylacetat) sowie eine Vielzahl aromatischer und aliphatischer Laktone. Zwei genetische Varianten im PON1-Gen sind mit einer reduzierten Enzymaktivität assoziiert.
Superoxiddismutase 2 (SOD2) schützt Mitochondrien vor oxidativem Stress durch freie Sauerstoffradikale. Außerdem spielt dieses Enzym eine große Rolle bei der Detoxifizierung von Amalgam. Eine Genveränderung ist assoziiert mit weniger aktivem Enzym, wodurch bei Trägern der Genveränderung die Gefahr besteht, dass die Mitochondrien geschädigt werden. Ein beschleunigter Alterungsprozess ist die Folge. Diese Patienten haben auch ein gesteigertes Risiko für Kardiomyopathie bei Eisenüberladung, knochendegenerative Prozesse, Autoimmunerkrankungen, männliche Unfruchtbarkeit, Brustkrebs, Eierstockkrebs und möglicherweise Parkinson.
Glukuronidierung und Sulfonierung sind wichtige Reaktionen, durch die Fremdstoffe, Medikamente und endogene Substanzen eine erhöhte Wasserlöslichkeit erhalten und ausgeschieden werden können. Die UDP-Glucuronosyltransferase 1A1 (UGT1A1) verstoffwechselt viele lipophile Xenobiotika (z.B. Zytostatikum Irinotecan, einige Antiepileptika, Statine), Bilirubin und Benz(a)pyren.
Indikationen
- Patienten mit Verdacht auf umweltmedizinische Erkrankungen durch berufliche oder anderweitige Schadstoffexposition
- präventiv bei Personen mit permanenter beruflicher Schadstoffexposition, insbesondere Kanzerogene (z.B. berufsbedingt in Lackierereien)
Zur Einschätzung der allgemeinen Entgiftungskapazität eines Patienten empfiehlt sich in der Regel die Untersuchung der Phase-II-Enzyme und je nach Schadstoffexposition die Untersuchung der zugehörigen Phase-I-Enzyme.
Abrechnung
Toxikogenetische Untersuchungen werden bei gegebener Indikation i.d.R. von privaten Kassen erstattet. Wir empfehlen die Einholung einer Kostenübernahmeerklärung im Vorfeld der Untersuchungen. Kassenversicherte können diese Leistungen als Selbstzahler anfordern.
Material
2 ml EDTA-Blut
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen. Bei genetischen Untersuchungen ist laut Gendiagnostikgesetz eine Einwilligung des Patienten erforderlich. Gern stellen wir Ihnen das Formular zur Verfügung (Tel.: 030- 77 001 220).
Literatur
- Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz (2004): Genetische Polymorphismen von Fremdstoffmetabolisierenden Enzymen und ihre Bedeutung für die Umweltmedizin. 47:1115-1123
- Schwab, M. et al. (2002): Pharmakogenetik der Zytochrom-P-450-Enzyme. Bedeutung für Wirkungen und Nebenwirkungen von Medikamenten. Deutsches Ärzteblatt 8 (Jg 99).
- Innocenti, F. & Ratain, M.J. (2002): Update on pharmacogenetics in cancer chemotherapy. Eur J Cancer 38: 639-644.
- P450 Medikamenten-Interaktionstabelle - medicine.iupui.edu/clinpharm/ddis/main-table/