IgA-Mangel – der häufigste primäre Immundefekt
Im Rahmen der Routinediagnostik findet man nicht selten ein vermindertes oder nicht messbares Immunglobulin A (IgA). Dies kann zum einen an einem selektiven Defekt (selektiver IgA-Mangel) liegen oder Teil eines kombinierten Immundefektes sein. Ein IgA-Mangel ist in 60% der Fälle klinisch unauffällig. Einige Patienten können jedoch auch vermehrt an häufigen Infekten, Autoimmunerkrankungen oder Allergien leiden. Mit einer Prävalenz von 1:500 in Kaukasiern ist ein selektiver IgA-Mangel der häufigste primäre Immundefekt. In anderen Ethnien, z.B. Asiaten, ist er hingegen relativ selten.
Physiologische Bedeutung von IgA
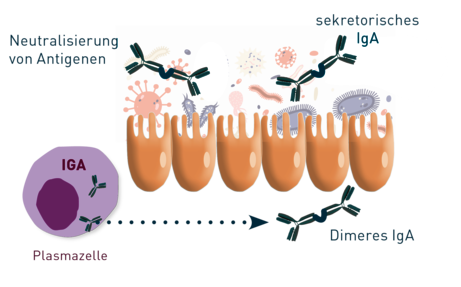
Immunglobulin A stellt den größten Teil der in unserem Körper produzierten Antikörper dar und wird vorwiegend auf inneren Körperoberflächen (Schleimhäute) und Sekreten (Speichel, Tränen und Muttermilch) freigesetzt. Hier spielt es eine wichtige Rolle bei der Immunabwehr und der Immuntoleranzinduktion. Durch die Bindung von Antigenen an das IgA können diese effektiv eliminiert werden und gelangen nicht durch unsere epithelialen Barrieren (Abb 1).
Diagnostische Konsequenzen eines nachgewiesenen IgA-Mangels
Nach internationalen Kriterien spricht man von einem IgAMangel, wenn die Konzentration des Serum-IgA bei Patienten ab 4 Jahren unter 7 mg/dl liegt. Da ein IgA-Mangel in seltenen Fällen auch vorrübergehend auftreten kann, empfiehlt sich eine Wiederholungsmessung nach 1-2 Monaten.
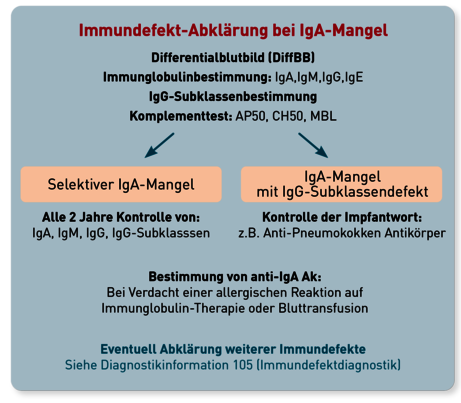
Patienten mit IgA-Mangel sind zwar nicht immer klinisch auffällig, dennoch ist eine erweiterte Immundefektdiagnostik sinnvoll. Hierzu sollte zur Differenzierung zwischen dem selektiven IgA-Mangel oder einem mit IgA-Mangel kombiniertem Immundefekt ein Differentialblutbild erstellt sowie die weiteren Immunglobuline (IgM, IgE, IgG) inkl. der IgG-Subklassen untersucht werden. Des weiteren empfiehlt sich die Kontrolle der Antikörper-abhängigen Immunfunktionen des Komplementsystems durch die Bestimmung von AP50, CH50 und Mannose-bindendem Lektin (MBL) (Abb. 2).
Da in Folge eines selektiven IgA-Mangels im Verlauf auch ein Verlust der IgG-Produktion auftreten kann und das Risiko der Entwicklung eines variablen Immundefekt- syndroms (CVID) besteht, sind regelmäßige Kontrolluntersuchungen der Immunglobuline sowie der IgG-Subklassen notwendig, insbesondere wenn sich der klinische Zustand der Patienten ändert (z.B. zunehmende Infektneigung). Eine zusätzliche wichtige diagnostische Konsequenz des IgA-Mangel hat zusätzlich wichtige diagnostische Konsequenzen: IgA-Serologien sind sowohl für Erreger (z.B: Yersinien, Chlamydien, Mycoplasmen, SARS-CoV 2) als auch im Rahmen der Zöliakie-Diagnostik nicht auswertbar, zur Diagnostik sind dann andere Antikörper (z.B. IgG) heranzuziehen.
Welche klinischen Folgen hat ein selektiver IgA-Mangel?
Über die Hälfte der Menschen mit einem selektiven IgAMangel haben keinerlei Symptome. Häufig ist es erst die Kombination mit anderen Defekten (z.B. Defizienz einer oder mehrerer IgG-Subklassen oder ein Komplementdefekt, bedingt durch eine verminderte AP50 oder CH50-Aktivität oder durch einen Mangel an (MBL)), die zu einer erhöhten Infektanfälligkeit führt. Bei diesen symptomatischen Patienten treten dann gehäuft bakterielle Infektionen (Mittelohrentzündungen sowie Infektionen der oberen Atemwege) auf. Als Erreger stehen Haemophilus influenzae oder Streptococcus pneumoniae im Vordergrund. In diesem Fall empfiehlt sich zum einen eine frühe Behandlung mit Antibiotika und zum anderen sollte der Impfstatus der Patienten kontrolliert werden.
Ein selektiver IgA-Mangel kann auch für gastrointestinale Erkrankungen und Nahrungsmittelunverträglichkeiten prädisponieren, da die erste immunologische Abwehr im Darm in Form des sekretorischen IgA fehlt. So besteht neben dem erhöhten Infektionsrisiko eine gesteigerte Prävalenz für chronisch-entzündliche Darmerkrankungen oder Zöliakie. Auch andere Autoimmunerkrankungen (z.B. Thyreoiditis, Vitiligo, Juvenile rheumatoide Arthritis (JIA), SLE, Typ 1-Diabetes, Dermatomyositis, Sjögren-Syndrom, Autoimmunhepatitis) treten gehäuft gemeinsam mit einem IgA-Mangel auf.
Anti-IgA-Antikörper: Anaphylaxie-Risiko bei IgA Mangel
Bei Patienten mit selektivem IgA-Mangel kann es zum Auftreten von Autoantikörpern gegen IgA kommen. Diese treten bei ca. 20-25% der betroffenen Patienten auf. Der labordiagnostische Nachweis ist deshalb wichtig, weil dies bei intravenöser Gabe von Immunglobulinen zu schwer- wiegenden anaphylaktischen Reaktionen und damit zu einer lebensbedrohlichen Situation führen kann. Dies schließt auch Bluttransfusionen mit ein.
Fazit für die Praxis
Nach einem selektivem IgA-Mangel (oder anderen assoziierten Antikörpermangelsyndromen) sollte gesucht werden bei:
- positiver Familienanamnese für IgA-Mangel und/oder
- dem Vorliegen einer Zöliakie, von Autoimmunphänomenen sowie einer Häufung von Infekten (obere und untere Atemwege, gastrointestinal)
Bei zufällig gefundenem oder gezielt diagnostiziertem IgA-Mangel sollte zur Abklärung mindestens untersucht werden:
Differentialblutbild
IgA, IgG, IgM, IgE
Ggf. IgG-Subklassen
Ggf. Komplementdiagnostik: AP50,CH50,MBL
Bei nachgewiesenem IgA-Mangel ist, im Abstand von 2 Jahren, eine regelmäßige Kontrolluntersuchung der Immunglobuline und der IgG-Subklassen sinnvoll. Auch die Untersuchung auf Anti-IgA-Antikörper ist wichtig, da Patienten mit IgA-Mangel und Autoantikörpern ein erhöhtes Anaphylaxie-Risiko für Immunglobulin-Therapien und Bluttransfusionen haben. Sollte die Gabe dieser Produkte notwendig werden, können dann IgA-abgereicherte Präparate verwendet oder andere Vorsichtsmaßnahmen ergriffen werden (z.B. die subkutane Immunglobulin-Therapie und Verzicht auf intravenöse Gabe).
Auf Grund der wichtigen Rolle von IgA in der primären Immunabwehr im Darm, sind Patienten mit IgA-Mangel besonders anfällig für Darm-Erkrankungen. Da eine Zöliakie nicht immer durch typische klinische Beschwerden auffällig ist, empfiehlt sich in jedem Fall deren Ausschluss (Diagnostikinformation 162).
Material und Abrechnung
Immunglobulin IgA, IgG, IgM, IgE: 5 ml Vollblut (Serum)
IgG-Subklassen: 5 ml Vollblut (Serum)
Anti-IgA Antikörper: 1 ml Vollblut (Serum)
Eine Abrechnung ist bei gegebener Indikation im kassen- und privatärztlichen Bereich gegeben.
Literatur
- Blaese et al. eds. Patient & Family Handbook for Primary Immuno- deficiency Diseases. 5th ed. Towson, MD: Immune Deficiency Foundation; 2013
- Yazdani et al. Selective IgA Deficiency: Epidemiology, Pathogenesis, Clinical Phenotype, Diagnosis, Prognosis and Management. Scand J Immunol (2017) 85:1
- Horn et al. Anti-IgA antibodies in Common Variable Immunodeficiency (CVID): Diagnostic workup and therapeutic strategy. Clinical Immunol (2008) 122
- Informationen zur Abklärung weiterer Immunfunktionen: Diagnostik- information 105
- Informationen zur Zöliakiediagnostik: Diagnostikinformation 162
- Informationen zu AP50/CH50: Diagnostikinformation 297
- Informationen zu MBL: Diagnostikinformation 153