/spezielle-kompetenzen/allergie/diagnostik-der-typ-i-allergie-soforttyp
Pathogenese und Diagnostik der Typ-I Allergie
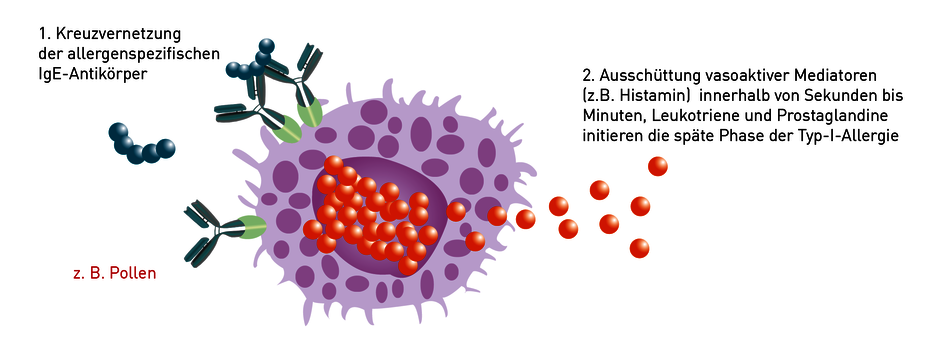
Bei der Typ I-Allergie bilden sich beim (symptomlosen) Erstkontakt allergenspezifische IgE-Antikörper. Diese binden sich an die Oberfläche von Mastzellen (histaminreiche Zellen die in allen Schleimhäuten vorhanden sind). Die Reaktion erfolgt beim Zweitkontakt innerhalb von Sekunden bis wenigen Minuten. Antigene sind im Allergiefall freie/gelöste Moleküle, die vom Immunsystem fälschlich als bedrohlich angesehen werden. Die Bindung des Antigens (Allergens) führt durch eine Kreuzvernetzung zweier oder mehrerer IgE-Antikörper zur Aktivierung der Mastzellen und Basophilen und zu deren Degranulierung. Es werden augenblicklich präformierte Entzündungsmediatoren wie Histamin, später auch neu synthetisierte Faktoren wie Leukotriene und Prostaglandine freigesetzt. Während Histamin vor allem für die Soforttypsymptomatik (Augentränen, Naselaufen, Juckreiz, Bronchospasmus, Anaphylaxie) verantwortlich ist, initiieren die Leukotriene und Prostaglandine die Entzündungsreaktion und damit die verzögerten und oft chronifizierten Beschwerden (Ekzeme, Asthma, Verstopfung der Nase).
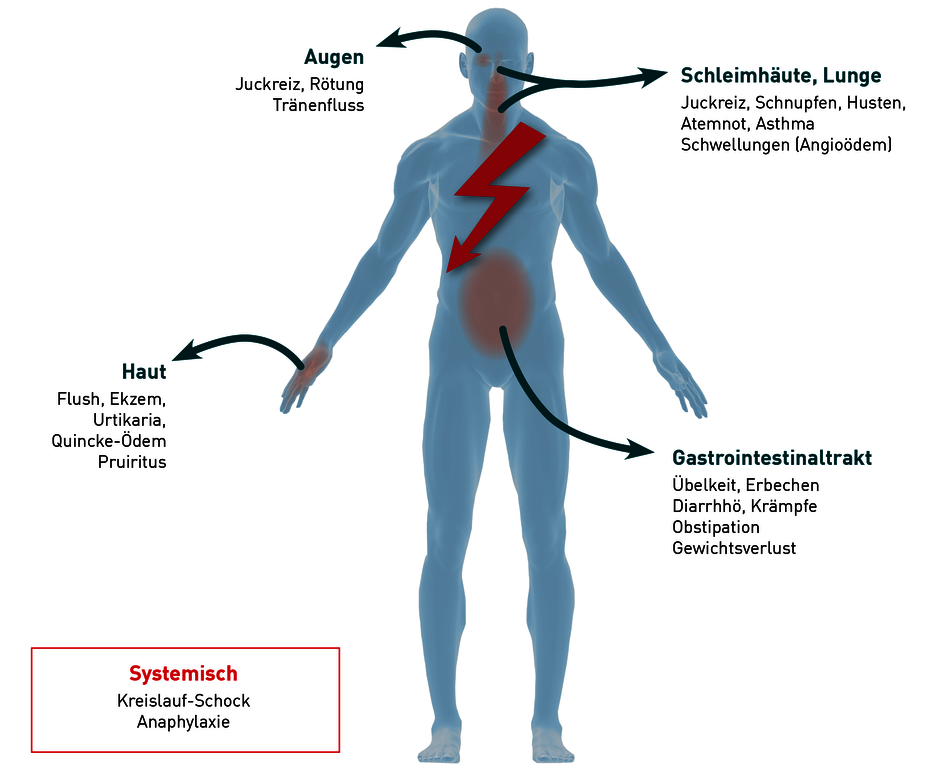
Während die Primärsymptome einer Soforttypallergie auf Inhalationsallergene häufig zuerst am Ort des Allergenkontaktes auftreten (z.B. allergische Rhinitis), muss es bei oral aufgenommenen Allergenen nicht zwangsläufig zu Magen-Darm-Beschwerden kommen. Häufig ist in diesem Fall auch die Haut betroffen (Urtikaria, Neurodermitis). Eine systemische Überreaktion (z.B. bei Wespengiftallergie), die sich vor allem am Bronchial- und Gefäßsystem manifestiert, wird als Anaphylaxie bezeichnet. Ursächlich für die Vielfältigkeit der Reaktionen ist die weitverbreitete Verteilung von Histamin-Rezeptoren. Diese befinden sich auf Zelloberflächen von Blutgefäßen, Bronchien, Darm, Hirn, Herz, Magen und Immunsystem. Patienten die über eine erhöhte Mastzellanzahl verfügen (z.B. Mastzellaktivierungssyndrom oder Mastozytose) setzen bei einer allergischen Reaktion eine erhöhte Konzentration an Histamin frei und haben somit ein erhöhtes Risiko für systemische allergische Reaktionen. Auch Patienten mit einer verminderten Abbaukapazität des Histamins (siehe Histaminintoleranz) können verstärkt an allergischen Reaktionen leiden.
Diagnostik der Typ-I Allergie
Neben dem Prick-Test, bei welchem die klinische Reaktion der Haut nach Auftragen einer standardisierten Allergenlösungen in Tropfenform untersucht wird, stehen Ihnen im Labor verschiedene qualitativ vergleichbare Methoden zur Verfügung. All diese Methoden haben den Vorteil, dass sie unabhängig von der Hautbeschaffenheit sind und auch unter Anti-Histaminika-Einnahme durchführbar sind.
Auf der einen Seite stellen die IgE-Antikörper einen wichtigen Biomarker zur Identifikation der Allergieauslöser dar. Sie können durch verschiedene Methoden im Blut bestimmt werden. Auf der anderen Seite ermöglicht der Basophilenaktivierungstest als in vitro Provokationstest sowohl die Untersuchung seltener, nicht kommerziell für die IgE-Diagnostik verfügbarer, Allergene und Pseudoallergene als auch eine erste Beurteilung der klinischen Relevanz bestehender Sensibilisierungen.
IgE-Diagnostik
Gesamt-IgE
Typ-I-Allergiker haben häufig aber nicht in jedem Fall ein erhöhtes Gesamt-IgE (Total-IgE) im Serum. Das Gesamt-IgE ist kein Screeningparameter für eine Typ-I-Allergie da, in Abhängigkeit vom Allergen, nur ca. 20% (Wespengiftallergie) bis 90% der Patienten (Pollenallergie) ein erhöhtes IgE aufweisen. Im Umkehrschluss ist ein erhöhtes Gesamt-IgE kein Garant dafür, dass man bei der Suche nach einem erhöhten allergen-spezifischen IgE-Titer fündig wird, auch bei parasitären Infektionen, Immundefekten, HIV-Infektionen oder bestimmten Autoimmunerkrankungen (z.B. Urtikaria) kann das Gesamt-IgE erhöht sein.
Das Gesamt-IgE sollte im Rahmen des Immunstatus bestimmt werden um den bei manifesten Typ-I-Allergien eintretenden TH2-Shift des zellulären Immunsystems einschätzen zu können. Im Verlauf kann das Gesamt-IgE auch als Progredienz-Marker dienen, wenn es initial erhöht ist (weitere Informationen zum gesamt-IgE).
IgE-Bestimmung mittels Fluoreszenz-Enzym-Immunoassay (FEIA)
Früher wurde die Bestimmung mit dem Radio-Allergo-Sorbens-Test (RAST) durchgeführt. Obwohl heute Enzymimmunoassays verwendet werden, hat sich umgangssprachlich der Begriff RAST gehalten. Die Ergebnisse werden quantitativ in kU/l ausgegeben. Der Messbereich ist 0,1 – 100 kU/l und in 6 Klassen unterteilt. Das CAP-System der Firma Phadia (Thermo Fisher) gilt international seit Einführung bis heute als Goldstandard für die serologische Allergie-Diagnostik. Die Untersuchung erfolgt vollautomatisch. Die Allergene sind an ImmunoCAP gekoppelt, eine Art Zelluloseschwamm mit sehr hoher Bindungskapazität. Das Referenzsystem ist am WHO-Standard kalibriert.
Mit dieser Methode können individuell Allergenmischungen, Extrakte oder Einzelallergene angefordert werden – unser Portfolio umfasst ca. 60 Allergenmischungen, 650 Einzelallergene und 90 Allergenkomponenten und kann dem Allergenverzeichnis entnommen werden.
Eine Stufendiagnostik ermöglicht Ihnen, die Anzahl der Untersuchungen entsprechend der Ergebnisse zu optimieren.
Kleines IgE-Allergenscreening mittels Immunoblot
Der EUROLINE-Blot ist ein Multiparameter-Test auf Membranbasis, der auf Grund des automatisierten EUROLineScan-Systems eine semi-quantitative Angabe von 20 bzw. 27 (Pädiatrie) verschiedenen Allergenen in einem Testlauf erlaubt. Über eine EUROBlot-Camera werden die Bandenintensitäten automatisiert in EAST-Klassen umgerechnet, so dass die Ergebnisse in dem in der Allergiediagnostik bewährten RAST (EAST)-Klassen-System ausgegeben werden können. Die Methode ist gemäß EN ISO 13485 zertifiziert und gehört in unserem Institut zu den akkreditierten Testverfahren.
Die Vorteile der Blot-Technik im Vergleich zur Einzelallergenbestimmung im FEIA (RAST) sind die deutliche Kostensenkung für Privat- und Selbstzahlerpatienten wenn in einem Untersuchungsgang eine breite Anzahl von Allergenen untersucht werden soll (Screening – ideal für die Pädiatrie) und dass die Analyse aus 1 ml Serum (Kleinkinder!) erfolgen kann. Leider kann der Blot seit dem 1.10.2008 nicht mehr über die gesetzliche Krankenkasse abgerechnet werden.
Detaillierte Informationen zu den Blot-Profilen und Preise
Umfangreiche IgE-Diagnostik im Multiplex-Verfahren
Bei mehrfach sensibilisierten Patienten oder bei uneindeutiger Klinik bzw. komplexer Anamnese ist die Bestimmung einzelner Allergene oft zeitaufwendig und langwierig. In solchen Fällen kann ein umfassendes Allergen-Screening die Diagnostische Detektivarbeit entscheidend erleichtern.
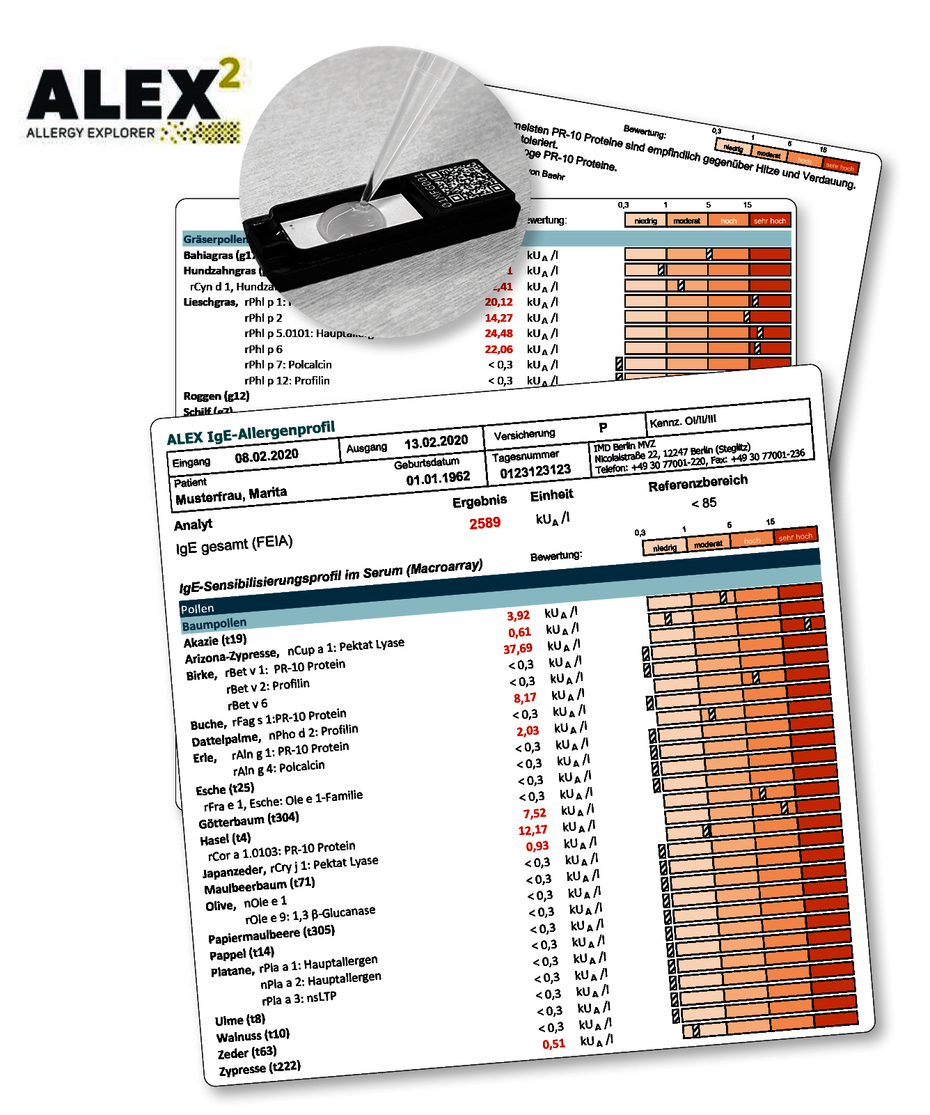
Im ALEX-IgE Profil werden neben dem gesamt-IgE auch spezifische IgE-Antikörper gegen knapp 300 Allergene, darunter fast 120 Extrakte und 180 Allergenkomponenten untersucht. Somit vereint dieser Test in einem Ansatz die klassische mit der molekularen Allergiediagnostik. Im ALEX werden so zum Einen 99% der relevantesten Allergieauslöser erfasst und zum anderen wird ein differenziertes Sensibilisierungsprofil erstellt. Dieses ermöglicht eine optimierte Risikoabschätzung potentieller allergischer Sensibilisierungen sowie die Identifikation von diagnostischen und klinischen Kreuzreaktionen. Somit hilft dieser Test insbesondere Vielfachallergikern bei der Therapie- und Diätoptimierung.
Basophilen-Aktvierungstest („in vitro“ Provokation)
Bei diesem zellulären Funktionstest werden die basophilen Granulozyten aus dem Patientenblut angereichert und die Freisetzung der vasoaktiven Mediatoren (d.h. von Leukotrienen) in Folge einer Stimulation mit Allergenextrakten oder auch nativen (mit eingesendeten) Allergenen bestimmt. Dieser Test besitzt eine sehr hohe Sensitivität und hohe klinische Relevanz (»in vitro-Provokationstest«).
Er eignet sich insbesondere in den Fällen, wo die klassische IgE-Diagnostik an ihre Grenzen stößt:
- wenn der vermutete Auslöser nicht für eine IgE-Diagnostik zur Verfügung steht
- bei Patienten mit sehr niedrigem gesamt-IgE
- bei lang zurückliegender Allergen-Exposition, da die Lebensdauer der zellgebundenen IgE-Antikörper im Vergleich zu den freien sehr viel länger ist (z.B. Insektengifte)
- Als klassischer »in vitro-Provokationstest« ist der BAT auch zum Nachweis von sogenannten Pseudoallergien geeignet, die nicht durch IgE-AK vermittelt sind (v.a. Medikamente, Nahrungsmittelzusätze oder Berufs- und Umweltallergene).
Eine Liste der im Labor vorrätigen Standardallergene finden Sie hier.
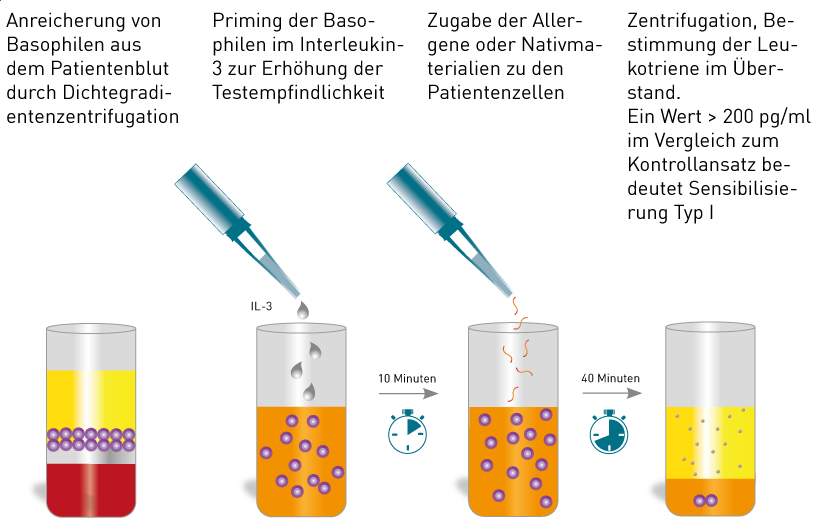
Das Verfahren beinhaltet folgende Schritte:
- Isolation der basophilen Granulozyten aus EDTA-Blut
- "Priming« der Basophilen mit Interleukin 3 zur Verbesserung der Testsensitivität
- Stimulation mit den entsprechenden Allergenextrakten
- Nach 40 Minuten Messung der bei bestehender Sensibilisierung freigesetzten Histamin-assoziierten Allergiemediatoren (Leukotriene)
Abb. Durchführung des Basophilenaktivierungstest (CAST-Methodik)
Bei Ergebnissen > 200 pg/ml Leukotrien nach Allergenstimulation nach Abzug des Basalwertes (nicht stimulierter Kontrollansatz) gilt eine Typ I-Sensibilisierung als gesichert.
Hinsichtlich Sensitivität und Spezifität hat sich in unserem Labor der BAT gegenüber anderen in vitro-Provokationstesten wie Histamin-Freisetzungs-Test oder CD63-Test, als eindeutig überlegen erwiesen.
Abb. Zur Diagnostik einer Medikamentenallergie der IgE-Bestimmung überlegen:
Nachweis einer NSAIR-Hypersensitivität auf Aspirin (ASS) und Diclofenac, nicht aber auf Ibuprofen.
Abb. Nachweis von Pseudoallergien auf Lebensmittelfarb- und Nahrungsmittelzusatzstoffe mit dem BAT. Es werden 18 E-Stoffe in 4 Gruppen oder auf Wunsch einzeln getestet.
Abb. Mittels Basophilenaktivierungstest kann die klinische Relevanz grenzwertiger IgE-Sensibilisierungen besser beurteilt werden.
Weitere diagnostische Marker
ECP (Eosinophilic Cationic Protein)
Mit dem ECP steht ein Serummarker zur Verfügung, über den die Aktivität einer Typ-I-allergischen Erkrankungen quantifizierbar ist.
Eosinophile Granulozyten sind bei Typ-I-Allergien in ihrer Zahl und Aktivität vermehrt (Achtung: auch bei parasitären und rheumatischen Erkrankungen). Auf Grund ihrer extremen Beweglichkeit dringen Eosinophile rasch in das allergisch-entzündliche Gewebe ein und setzen hier unterschiedliche Mediatoren aus ihren Granula frei. Eines davon ist das extrem zytotoxisch wirkende Eosinophilic Cationic Protein (Membranzerstörung) neben Leukotrienen (LTC4), Plättchen-Aktivierendem Faktor (PAF) und Sauerstoff-Radikalen. Die Freisetzung findet sich in verstärktem Maße bei Patienten mit Asthma bronchiale im Lungenepithel und in der ekzematös veränderten Haut von Patienten mit atopischem Ekzem sowie bei allergischer Rhinitis. Der Gewebespiegel korreliert zum Serumwert.
Die Höhe des ECP-Spiegels im Serum beschreibt wesentlich besser als das IgE den allergischen Entzündungsprozess, d.h. den Aktivierungszustand der Eosinophilen. Es korreliert sehr gut mit der Krankheitsaktivität bzw. dem Schweregrad von Erkrankungen des atopischen Formenkreises.
Tryptase
Die Höhe des Tryptase-Serumspiegels ist ein Maß für die Anzahl an Mastzellen im Organismus (basale Tryptasekonzentration). Zusätzlich wird reife Tryptase während der Aktivierung von Mastzellen durch IgE-vermittelte oder andere Mechanismen in die Blutbahn abgegeben. Eine hohe basale Tryptasekonzentration wird zum einen mit einem erhöhten Anaphylaxie-Risiko und zum anderen mit Mastozytose assoziiert. Ein plötzlicher Anstieg der Tryptase-Serumkonzentration mit anschließendem Abfall innerhalb von 48 Stunden deutet auf eine Mastzellaktivierung hin und stellt ein Hilfsmittel zur Bestätigung einer anaphylaktischen Reaktion dar. In der Gerichtsmedizin dient eine erhöhte postmortale Tryptase als strenges Indiz für eine Anaphylaxie-bedingte Todesursache.