Weiterführende Diagnostik bei fraglicher Bienen- und Wespengiftallergie
Allergien gegen Bienen- und Wespengift sind die wichtigsten Formen der Insektengiftallergie. Hornissen- und Hummelgiftallergien kommen seltener vor. Allergische Reaktionen gegen Insektengifte manifestieren sich meist als gesteigerte Reaktionen im Stichbereich, bei bis zu 3,5 % der Bevölkerung treten anaphylaktische Reaktionen auf [1].
Diagnostik nur bei positiver Anamnese empfohlen
Bei bestehendem Verdacht auf eine Bienen- und/oder Wespenallergie muss zunächst die klinische Klassifikation der Stichreaktion erfolgen. Gemäß Leitlinie [2] sollte ausschließlich bei systemischen Soforttypreaktionen der Nachweis einer IgE-vermittelten Insektengiftsensibilisierung sowie die Erfassung des individuellen Anaphylaxie-Risikos mittels Tryptase-Bestimmung des Patienten erfolgen. Um eine maximale Sensitivität zu gewährleisten, sollte die erste Untersuchung 1-4 Wochen nach dem klinischen Ereignis durchgeführt werden. Bei einem negativen Ergebnis trotz eindeutigem Verdacht ist eine Wiederholung 4-6 Wochen später empfehlenswert [3,4].
Was tun, wenn Biene und Wespe positiv sind?
Durch die komplexe Struktur und durch homologe Peptidsequenzen in Bienen- und Wespengiftallergenen kommen bei der Extrakt basierten IgE-Diagnostik nicht selten falsch positive Ergebnisse vor. Für die Patientenaufklärung und noch mehr für die Planung einer Hyposensibilisierung ist es aber wichtig zu wissen, ob eine Bienen- oder Wespengiftallergie oder tatsächlich eine Doppelsensibilisierung vorliegt.
Die Ursachen doppelt positiver IgE-Ergebnisse sind:
- Echte spezifische Doppelsensibilisierung auf Bienen- und Wespengift
- Falsch positive Resultate durch kreuzreaktive Kohlenhydratseitenketten (CCDs)
- Sensibilisierung gegen Proteine mit homologen Petidsequenzen in Bienen- und Wespengift (Hyaluronidasen, Dipeptidylpeptidasen), die klinisch aber oft ohne Bedeutung sind.
Was ist die Lösung?
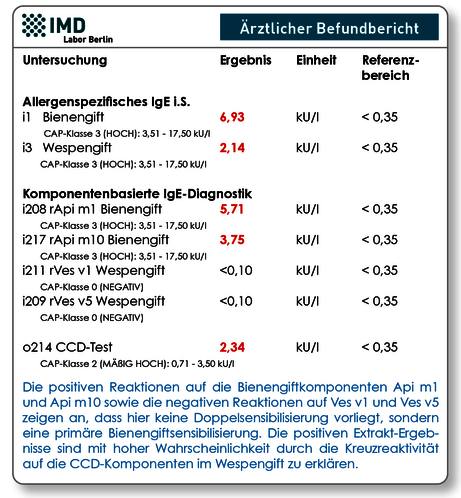
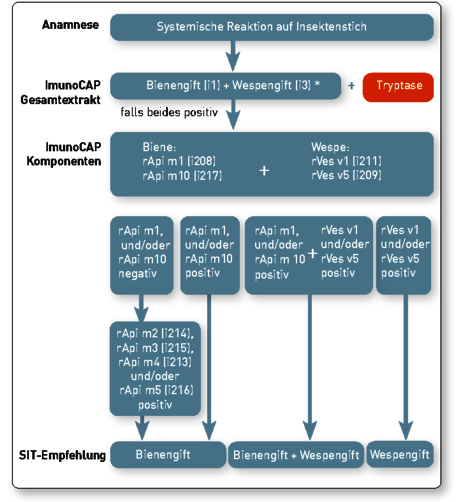
Bei doppelt positiven Ergebnissen sollte die Bestimmung des spezifischen IgE gegen die Allergenkomponenten der Hymenopterengifte mittels molekularer Allergiediagnostik erfolgen. Hier stehen Ihnen für Bienengift die 5 wichtigsten Komponenten Api m1, Api m2, Api m3, Api m4, Api m5 und Api m10 zur Verfügung. Für Wespengift sind die Komponenten Ves v1 und Ves v5 verfügbar (Tab. 1). Wichtigster Vorteil ist, dass diese gentechnisch (rekombinant) hergestellten Allergenkomponenten keine kreuzreagierenden Kohlenhydratseitenketten (CCD-Epitope) enthalten und somit eine bessere Abgrenzung zwischen echter Doppelsensibilisierung und Kreuzsensibilisierung möglich ist (Abb. 1).
Abb.1 Symptomprofil „Abklärung Bienen-/Wespengiftallergie“ eines 13-jährigen Jungen nach anaphylaktischer Reaktion auf einen Insektenstich. Die komponentenbasierte Diagnostik auf die spezifischen Giftallergene zeigte, dass der Patient ausschließlich gegen Bienengift allergisiert ist.
Tab. 1 Bienen- und Wespengiftkomponenten und deren Eigenschaften
| Allergen | Funktion | Klinische Bedeutung | Kreuzreaktivität |
|---|---|---|---|
| Bienengift (i1) | |||
| rApi m1 (i208) | Phospholipase A2* | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl | mit Phospholipase A2 der Hummel möglich |
| rApi m2 (i214) | Hyaluronidase* | Minorallergen | mit Hyaluronidase der Wespe möglich |
| rApi m3 (i215) | Saure Phosphatase* | Majorallergen, spezifischer Marker einer Primärsensibilisierung, Immuntherapieauswahl (Api m3 kann in therapeutischen Extrakten unterrepräsentiert sein) | |
| rApi m4 (i213) | Mellitin | Majorallergen, spezifischer Marker einer Primärsensibilisierung | |
| rApi m5 (i216) | Peptidylpeptidase IV* | Majorallergen
| mit Peptidylpeptidase IV der Wespe möglich |
| rApi m10 (i217) | Icarapin* | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl (Api m10 kann in therapeutischen Extrakten unterrepräsentiert sein) | |
| Wespengift (i3) | |||
| rVes v1 (i211) | Phospholipase A1
| Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl
| mit Phospholipase A1 verschiedener Wespen und Hornissen möglich |
| rVes v5 (i209) | Antigen 5
| Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl
| mit Antigen 5 verschiedener Wespen und Hornissen möglich |
| Feldwespengift (i77) | |||
| rPol v5 (i210) | Antigen 5 | Majorallergen, spezifi scher Marker einer Primärsensibilisierung, Immuntherapieauswahl | mit Antigen 5 verschiedener Wespen und Hornissen möglich |
*Native Proteine enthalten CCD-Komponenten
Da bereits 87 % der Bienengift-Allergiker spez. IgE auf Api m1 und Api m10 aufweisen, empfehlen wir Ihnen entweder unser Symptomprofil „Abklärung Bienen/Wespengiftallergie (Abb. 1) oder folgende Stufendiagnostik:
* Wenn beide Extrakte negativ sind sollte auch an den BAT und/oder andere Inseten gedacht werden (z. B. Feldwespe (i77))
Die IgE-Testungen ist negativ oder grenzwertig aber der klinische Verdacht bleibt?
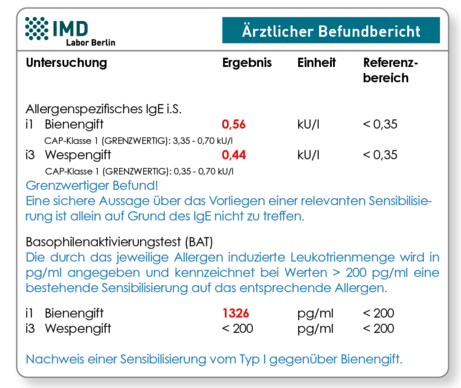
Bei klinischem Verdacht auf Bienen- und/oder Wespengiftallergie aber negativem oder fraglich positivem spezifischen IgE empfiehlt sich der Basophilenaktivierungstest (BAT ehemals BDT*) als zelluläres Testverfahren. Dieser kann in Einzelfällen deutlich positive Ergebnisse zeigen, sogar bei negativem spezifischen IgE. Dies gilt ins Besondere wenn das Stichereignis bereits lang (>6 Monate) zurückliegt, da die Lebensdauer der Zellgebundenen IgE-Antikörper im Vergleich zu den freien IgE-Antikörpern (nur diese werden im IgE-Test erfasst) deutlich länger ist. In seltenen Fällen (ca. 2 %) können Patienten auch über sogenannte hochaffine IgE-Antikörper verfügen die ausschließlich in gebundener Form an Mastzellen und basophile Granulozyten vorkommen. Typisch ist bei diesen Patienten ein oft auffällig niedriges Gesamt-IgE. Der Basophilenaktivierungstest (BAT ehemals BDT*) ist ein Testverfahren, bei dem aus Patientenblut angereicherte basophile Granulozyten in vitro mit den Allergenen stimuliert werden. Im Falle einer Sensibilisierung sezernieren diese Zellen Histamin und Leukotriene. Im BAT-Test werden die Leukotriene C4, D4 und E4 erfasst. Durch Vergleich der unstimulierten (basalen) Leukotrienproduktion mit einer allergenstimulierten Probe, kann eine individuelle Sensibilisierung des Patienten mit hoher Sensitivität nachgewiesen werden. (5)
Abb. 2 Der IgE-Nachweis zeigte (grenzwertige) Befunde. Erst im nachfolgend durchgeführten BAT-Test konnte eindeutig die Diagnose einer Bienengiftallergie gestellt werden.
Bei nachgewiesener Hymenopterengiftallergie immer auch die Tryptase untersuchen!
Zur Risikoabschätzung bei Bienen- und Wespengiftallergikern, insbesondere auch vor einer Spezifischen Immuntherapie (SIT) mit Insektengift, sollte die Bestimmung der Tryptase im Serum erfolgen. Bei erhöhter Tryptase besteht ein signifikant erhöhtes Risiko eine sehr schwere Stichreaktion bis zur Anaphylaxie zu erleiden.
Material
Spezifisches IgE, Tryptase: 3 ml Serum
BAT: 2 ml Heparinblut pro Allergen (alternativ EDTA-Blut)
Anforderung
- Symptomprofil „Abklärung Bienen/Wespenallergie“ (ICAP23)
- Spezifisches IgE gegen Gesamtextrakte der Biene (i1) und der Wespe (i3)
- Spezifisches IgE gegen die Bienengiftkomponenten rApi m1 (i208), rApi m2 (i214), rApi m3 (i215), rApi m4 (i213), rApi m5 (i216) und rApi m10 (i217) sowie gegen die Wespengiftkomponenten rVes v1 (i211) und rVes v5 (i209)
- Tryptase
- Basophilenaktivierungstest (BAT) auf i1 Biene und i3 Wespe
Abrechnung
Alle genannten Analysen werden sowohl von der gesetzlichen wie auch der privaten Krankenkasse übernommen.
Literatur
[1] Schäfer T, Epidemiologie der Insektengiftallergie. Allergo J 2009; 18: [1] 353-8
[2] AWMF-Leitlinie 061/020: Diagnose und Therapie der Bienen- und Wespengiftallergie
[3] Goldberg A et al, Timing of venom skin tests and IgE determinations after insect sting anaphylaxis. JACI 1997; 100:182-4
[4] Matricardi PM et al. EAACI Molecular Allergology User’s Guide. Pediatr. Allergy Immunol. 2016, 27 Suppl 23: 1-250
[5] Wedi B, Kapp A. Cellular in-vitro assays. Applicability in daily routine Hautarzt. 2010;61:954-60.
* BDT = Basophilen-Degranulations-Test