Mit CYP2D6-Gentest Tamoxifentherapie beim Mammakarzinom optimieren
Brustkrebs ist der häufigste bösartige Tumor der Frau − in Deutschland erkranken jedes Jahr ca. 70.000 Frauen. Bis zu 80% der Brustkrebstumore weisen Östrogenrezeptoren auf. Tamoxifen wird zur Behandlung dieser Östrogenrezeptorpositiven Mammakarzinome bei prä- und postmenopausalen Frauen seit den 70er Jahren eingesetzt. Bei dieser Tumorart hängen das Wachstum sowie die Vermehrung der Krebszellen vom körpereigenen Hormon Östrogen ab. Tamoxifen ist ein Anti-Östrogen und als Prodrug (Vorstufe) nicht ausreichend wirksam. Erst die Abbauprodukte (Metabolite) von Tamoxifen binden mit höherer Affinität an den Östrogenrezeptor und hemmen das Krebszellwachstum. Die körpereigene Kinetik des Tamoxifen-Abbaus ist daher elementar für die Wirksamkeit des Medikaments.
Therapeutisch wirksam sind die körpereigenen Abbauprodukte (Metabolite) von Tamoxifen
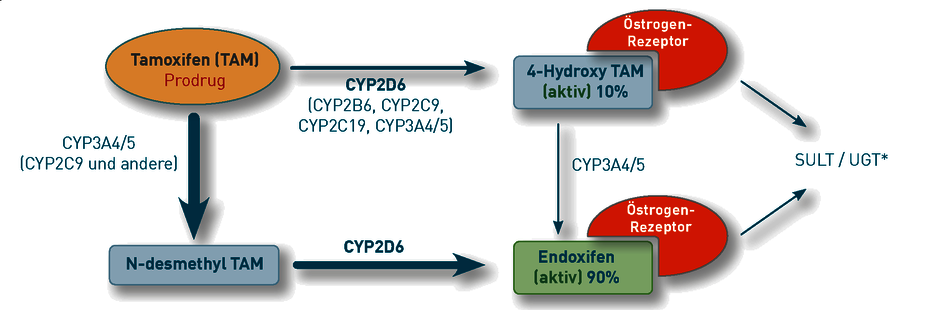
Die Aktivierung von Tamoxifen zu Endoxifen erfolgt in der Leber. Der Phase 1-Abbau von Tamoxifen wird durch Enzyme der Cytochrom P (CYP) 450-Familie katalysiert (Abb. 1). Ein Großteil wird zunächst durch CYP3A4/CYP3A5 in N Desmethyl-Tamoxifen umgewandelt. Sowohl dieser Metabolit als auch Tamoxifen selbst werden durch CYP2D6 weiter zu Endoxifen (90%) und 4-Hydroxy-Tamoxifen (10%) verstoffwechselt. Beide Produkte haben eine wesentlich höhere Affinität zum Östrogenrezeptor als Tamoxifen. Da Endoxifen aber in vielfach höherer Plasmakonzentration vorliegt, stellt es die eigentlich pharmakologisch wirksame Substanz dar (Jin et al., 2005).
Cytochrom P450 (CYP450) – Enzyme (Phase 1)
Die Phase 1 der Leberentgiftung besteht aus Monooxygenasen (CYP2D6, 1A1, 2C19, usw.), die substratspezifisch sowohl körpereigene als auch Fremdsubstanzen wie Medikamente und Umweltgifte verstoffwechseln, um sie dann in der Phase 2 wasserlöslich, d.h. „ausscheidbar“ zu machen (z.B. durch Kopplung mit Glutathion).
Genetische Varianten der CYP450-Enzyme können die Geschwindigkeit des Wirkstoffabbaus deutlich verändern. Ein Ultraschnell-Metabolisierer baut das Medikament zu schnell ab und erreicht eventuell keine wirksamen Blutspiegel, die Medikamentenwirkung ist unzureichend. Ein Langsam-Metabolisierer baut das Medikament nur unzureichend ab, es können toxische Blutspiegel erreicht werden und die Patientin leidet unter den Medikamentennebenwirkungen, ohne eine adäquate Wirkung zu haben. Um ein möglichst optimales Therapieregime für die Patientinnen festlegen zu können, sollten vor einer Tamoxifen-Therapie die häufigsten genetischen Sequenzvarianten von CYP2D6 untersucht werden
Genetische Varianten des CYP2D6-Gens reduzieren die Wirksamkeit von Tamoxifen (Pharmakogenetik)
Eine Schlüsselrolle bei der Aktivierung von Tamoxifen hat das Enzym CYP2D6. Allerdings ist dieses nicht bei allen Frauen gleich aktiv. Bisher sind über 80 verschiedene Sequenzvarianten bekannt, die für vier CYP2D6-Phänotypen kodieren:
EM – Extensive Metabolizer (normal)
IM - Intermediate Metabolizer (intermediär)
PM – Poor Metabolizer (langsam)
UM – Ultrarapid Metabolizer (ultraschnell)
Viele Frauen tragen genetische Varianten des CYP2D6- Gens, die die Enzymaktivität und damit die TamoxifenWirksamkeit beeinflussen. 7% der europäischen Bevölkerung haben kein funktionelles CYP2D6-Enzym, sind also sogenannte poor metabolizer und zeigen eine um 75% niedrigere Endoxifenkonzentration als Menschen mit normaler Aktivität. Weitere 15% verfügen über eine reduzierte CYP2D6-Aktivität (intermediate metabolizer) und 3% sind ultrarapid metabolizer.
Abb. 1 Phase 1-Metabolismus von Tamoxifen. Der Abbau wird durch die Enzyme CYP2D6 und CYP3A4/5 katalysiert. Der Metabolit Endoxifen ist die pharmakologisch wirksame Substanz (modifiziert nach Goetz et al., 2008). * Weiterer Abbau der Metabolite über Sulfotransferasen (SULT) und UDP-Glucuronosyltransferasen (UGT).
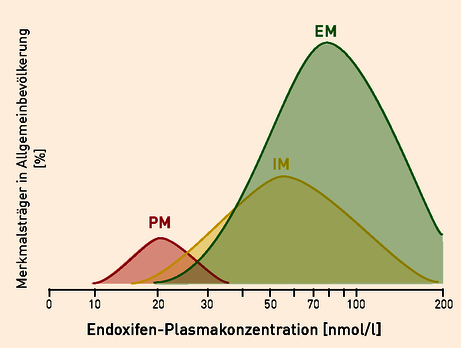
Eine verminderte CYP2D6-Aktivität verringert die Endoxifenkonzentration im Plasma (Abb. 2) und damit die Wirksamkeit der Therapie.
Abb. 2 Endoxifen-Plasmaspiegel bei Patientinnen unter Tamoxifen-Therapie in Abhängigkeit ihres CYP2D6-Metabolisiererstatus. Die Fläche unter den Kurven entspricht der Häufigkeit des jeweiligen Metabolisierungstyps in der Studienpopulation (modifiziert nach Lyon et al. 2012)
Interaktionen mit anderen Medikamenten (Pharmakokinetik)
Während einer Tamoxifen-Therapie sollte auf die zusätzliche Gabe von starken CYP2D6-Inhibitoren (wie Paroxetin, Fluoxetin, Chinidin, Cinacalcet oder Bupropion) verzichtet werden, da sie das CYP2D6-Enzym zusätzlich kompetitiv hemmen und so die Endoxifen-Plasmakonzentration im Blut um bis zu 75% verringern (Arzneimittel-Fachinformation Tamoxifen). SSRIs wie Paroxetin spielen bei Brustkrebspatientinnen in Deutschland eine zunehmende Rolle, da sie neben der Behandlung von Depressionen auch „off label use“ zur Behandlung von Hitzewallungen eingesetzt werden. Zur Behandlung ist hier eher der Einsatz von schwachen CYP2D6- Inhibitoren wie Citalopram empfohlen.
Nutzen des Gentests für die Praxis
Der CYP2D6-Gentest kann bereits vor Beginn der Tamoxifen-Therapie durchgeführt werden und gibt Hinweise darauf, wie effektiv Tamoxifen in Endoxifen umgewandelt wird und liefert einen Anhaltspunkt für die Wahl eventueller KoMedikationen. Frauen können aber auch während der Therapie überprüfen lassen, welche Serumkonzentrationen von Tamoxifen und seinen aktiven Metaboliten erreicht werden. Spricht dieser Befund gegen eine optimale Aktivierung von Tamoxifen, d.h. die aktiven Metabolite liegen nicht im therapeutischen Bereich, so kann eine Genanalyse mögliche Aufklärung bringen.
Das Wissen um die Aktivität des CYP2D6 sowie mögliche Nebenwirkungen der Therapie beeinflussen maßgeblich die Compliance der betroffenen Patientinnen. Denn mit der Sicherheit, dass Tamoxifen optimal aktiviert wird und so das Brustkrebswachstum effektiv hemmt, wird die dauerhafte Einnahme erträglicher.
Zudem gibt das CYP2D6-Ergebnis nicht nur Aufschluss über die Wirksamkeit und Verträglichkeit von Tamoxifen, sondern ca. 25% aller gängigen Medikamente wie Antidepressiva, Antipsychotika, Antiarrhythmika, Betablocker, Opiod-Analgetika, Neuroleptika und weitere werden darüber metabolisiert.
Nutzen des Gentests für die Praxis
Die Kenntnis der CYP2D6-Varianten der Patientin gibt den Hinweis darauf, wie effektiv Tamoxifen in Endoxifen umgewandelt werden kann, und liefert einen Anhaltspunkt für die Wahl eventueller Ko-Medikationen. Für Patientinnen mit inaktiven Varianten des CYP2D6-Gens bieten Aromatase-Inhibitoren wie Anastrozol eine gute alternative Behandlungsmöglichkeit (ATAC 2008).
Diagnostik
Die Analyse des CYP2D6-Gens erfolgt molekulargenetisch durch Sequenzierung der Exons 1-6 sowie durch PCR-basierten Nachweis einer möglichen Deletion (CYP2D6*5) oder Dupli-/Multiplikation (CYP2D6*xN). Die Untersuchung erfasst die häufigsten funktionsverändernden CYP2D6-Genvarianten in der europäischen Bevölkerung.
Die Wirkstoffbestimmung von Tamoxifen und seinen drei Metaboliten erfolgt mittels LC-MS.
Indikation
- Therapie und Nachsorge Östrogenrezeptor-positiver Mammakarzinome
Material
CYP2D6-Genanalyse: 2 ml EDTA-Blut
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen. Für die genetische Untersuchung benötigen wir die Einverständniserklärung des Patienten.
Wirkstoffspiegel-Bestimmung Tamoxifen & Metaboliten: Serum/Vollblut (innerhalb von 24h lichtgeschützt)
Blutentnahme bitte im steady state (mind. 35 Tage Tamoxifen) und im Talspiegel (d.h. unmittelbar vor erneuter Medikamenteneinnahme). Für die Wirkstoffbestimmung nutzen Sie bitte den Medikamenten-Anforderungsschein.
Abrechnung
Die CYP2D6-Genanalyse wird von den privaten Kassen (GOÄ) getragen. Kassenpatienten erhalten diese Untersuchung als Selbstzahlerleistung. Die Medikamentenspiegelbestimmung ist im kurativen Fall im Leistungsspektrum des EBM und der GOÄ enthalten.
Literatur
- Goetz et al. (2008): Tamoxifen pharmacogenomics: The role of CYP2D6 as a predictor of drug response. Clinical Pharmacology & Therapeutics 83:160-166.
- Lyon et al. (2012): Laboratory testing of CYP2D6 alleles in relation to tamoxifen therapy. Genet Med 14(12):990-1000.
- Jin et al (2005): CYP2D6 genotype, antidepressant use, and tamoxifen metabolism during adjuvant breast cancer treatment. Journal of the National Cancer Institute 97:30-39.
- Schroth et al. (2009): Association between CYP2D6 polymorphisms and outcomes among women with early stage breast cancer treated with tamoxifen. JAMA 302 (13):1429-36.
- Swen et al. (2011): Pharmacogenetics: from bench to byte – an update of guidelines. Clin. Pharm.&Therp.;89(5):662-73.
- Fees-Leopold und Steinberger (2016): Tamoxifen-Therapie und CYP2D6- Genotypisierung. Frauenarzt 57 Nr.10.
- The Pharmacogenomics Knowledgebase´(http://www.pharmgkb.org/)
- Goetz et.al. (2018): Clinical Phamacogenetics Implementation Consortium (CPIC) Guideline for CYP2D6 and Tamoxifen Therapy. Clinical Pharmacology & Therapeutics.
- Arzneimittel-Fachinformation Tamoxifen