Pharmakogenetische Diagnostik zur Dosisanpassung von Chemotherapeutika
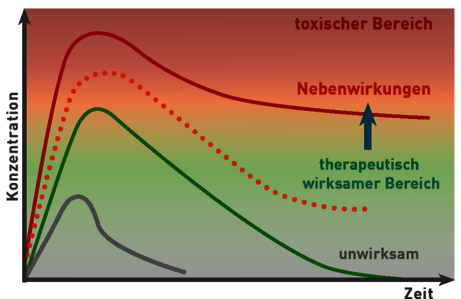
In der Tumortherapie werden viele Chemotherapeutika eingesetzt, oft mit sehr unangenehmen Nebenwirkungen, die bei dem einen Patienten nur schwach, bei dem Anderen sehr stark ausfallen. Das liegt daran, dass der Abbau der Substanzen durch genetisch bedingt veränderte Enzymaktivitäten gestört sein kann. So kann es vorkommen, dass bei Patienten mit verlangsamtem Arzneimittelmetabolismus unter Standarddosierung des Medikaments schwere bis lebensbedrohliche Nebenwirkungen auftreten. Bei Patienten mit gesteigertem Arzneimittelmetabolismus ist das Medikament hingegen nicht ausreichend wirksam.
Abb. 1 Konzentrations-/Zeitverlauf eines Arzneimittels. Unterschiedliche Enzymaktivitäten bedingen verschieden hohe Plasmakonzentrationen eines Arzneimittels ( normale (grüne Linie), verminderte (orange Punkte), stark reduzierte / keine Enzymaktivität).
Ziel der Pharmakogenetik ist es, durch Untersuchung von entsprechenden Genvarianten, Voraussagen über die Wirksamkeit und Verträglichkeit von Arzneimitteln zu machen und damit eine individualisierte Pharmakotherapie zu ermöglichen.
Die Dosis des Chemotherapeutikums kann entsprechend vor Therapiebeginn durch die Untersuchung der nachfolgenden Genvarianten angepasst und schwerwiegende Nebenwirkungen vermieden werden. |
Wir weisen darauf hin, dass bei Therapiebeginn trotz Testung der Genvarianten, die in den jeweiligen Fachinformationen empfohlenen Sicherheitsmaßnahmen und Untersuchungen zu beachten sind.
TPMT-Genanalyse
Thiopurin-Toxizität durch Azathioprin, 6-Mercaptopurin, 6-Thioguanin
Indikation: akute Leukämie, chronisch entzündliche Darmerkrankungen, andere Autoimmunkrankheiten wie Rheumatoide Arthritis, zur Vorbeugung der Abstoßungsreaktion nach allogener Organtransplantation
Mechanismus: Einbau der aktiven Metabolite in die Erbsubstanz; Hemmung der Zellteilung → Inaktivierung der Metabolite durch Thiopurin-S-Methyltransferase (TPMT)
Prävalenz Europäer: 0,3 % homozygote (komplette TPMTDefizienz), 10 % heterozygote Genträger (partielle TPMTDefizienz)
Nebenwirkungen: Myelosuppression, Anämie, Leukopenie, Pankreatitis
Konsequenz: komplette TPMT-Defizienz → Thiopurin-Therapie kontraindiziert oder erhebliche Dosisreduktion, partielle TPMT-Defizienz → Dosisreduktion erwägen
Arzneimittelinteraktionen: Aminosalicylate wie Sulfalazin (Inhibitor von TPMT)
UGT1A1-Genanalyse
Irinotecan (CPT11)-Toxizität
Indikation: metastasiertes kolorektales Karzinom, metastasiertes Adenokarzinom des Pankreas
Mechanismus: Uridin-Diphosphat-Glucuronosyltransferase 1A1 (UGT1A1) glukuronidiert den zytotoxisch wirksamen aktiven Metaboliten SN38 in den inaktiven Metaboliten
Prävalenz Europäer: 11% homozygote (Langsam-Metabolisierer), 50% heterozygote Genträger (Intermediär-Metabolisierer)
Nebenwirkungen: schwere Neutropenie, Diarrhö, Anämie, Thrombopenie
Konsequenz: UGT1A1-Langsam-Metabolisierer → geringere Anfangsdosis, besonders bei Dosen über 180 mg/m2 Körperoberfläche, Dosissteigerung bei guter Verträglichkeit in Abhängigkeit der Neutrophilenzahl
Substrate von UGT1A1: Bilirubin (Indikation: Morbus Meulengracht!), Didanosin, Lamivudin, Lamotrigin, Nevirapin, Paracetamol, Stavudin
Arzneimittelinteraktionen: Clozapin, Johanniskraut, Rifampicin
DPYD-Genanalyse
5-Fluorouracil (5-FU)-Toxizität, Capecitabin oder Tegafur
Indikation: verschiedene Tumorarten wie kolorektales Karzinom, Mammakarzinom, Magenkarzinom, Plattenepithelkarzinom im Kopf- und Halsbereich
Mechanismus: 5-FU (Pyrimidinanaloga) wird bei der Zellteilung als „falscher“ DNA-Baustein eingebaut, wodurch die Erbinformation nicht mehr vervielfältigt wird, Dihydropyrimidin-Dehydrogenase (DPYD) baut ca. 80% des 5-FU ab
Prävalenz Europäer: 12 % heterozygote (partielle DPYDDefizienz), 0,06 % homozygote Genträger (komplette DPYDDefizienz)
Nebenwirkungen: schwere Neutropenie, Neurotoxizität, schwere Diarrhöe, Stomatitis
Konsequenz: komplette DPYD-Defizienz → Therapie kontraindiziert, partielle DPYD-Defizienz → Reduktion der Anfangsdosis, sukzessive Dosissteigerung unter therapeutischer Arzneimittelüberwachung (TDM Therapeutic Drug Monitoring)
MTHFR-Genanalyse
Methotrexat (MTX)-Unverträglichkeit
Indikation: Hochdosistherapie z.B. von akuter lymphatischer Leukämie, Niedrigdosistherapie bei chronischentzündlichen Erkrankungen wie rheumatoider Arthritis, Psoriasis oder Morbus Crohn
Mechanismus: MTX hemmt die MethylentetrahydrofolatReduktase MTHFR (Homocystein → Methionin) durch die Hydrierung von Folsäure
Prävalenz Europäer: C677T (10 % homozygot bzw. 40 % heterozygote Genträger mit nur 35 bzw. 60 % Rest Enzymaktivität)
Nebenwirkungen: Thrombozytopenie, Leukopenie, Diarrhö, Stomatitis, Hyperhomocysteinämie (Risikofaktor für atherosklerotische Gefäßveränderungen, venöse Thrombosen)
Konsequenz: reduzierte MTX Initialdosis; Dosissteigerung in Abhängigkeit der Verträglichkeit
Arzneimittelinteraktionen: Acetylsalicylsäure, Ciprofloxacin, Cotrimaxol
CYP2C8-Genanalyse
Paclitaxel-Unverträglichkeit
Indikation: Bronchial-, Pankreas-, Prostata-, Mamma-/Ovarialkarzinom
Mechanismus: Störung der Zellteilung → Hemmung der Vermehrung der Tumorzellen
Frequenz Europäer: 2 % homozygote (Langsam-Metabolisierer), 13 % heterozygote Genträger (Intermediär-Metabolisierer)
Nebenwirkungen: Alopezie, gastrointestinale Störungen (Nausea, Vomitus, Diarrhö, Mucositis), Neutropenie, Thrombozytopenie, periphere Neuropathie
Konsequenz: Langsam-Metabolisierer → reduzierte Paclitaxel Initialdosis; Dosissteigerung in Abhängigkeit der Verträglichkeit
Substrate von CYP2C8: Statine (Simvastatin, Fluvastatin), Analgetika (Diclofenac, Ibuprofen), usw.
Arzneimittelinteraktionen: Clozapin, Gemfibrozil (starker Inhibitor von CYP2C8), Rifampicin (starker Induktor von CYP2C8)
Pharmakogenetische Analysen
| Gen | Allel / SNP* | dbSNP ID | Medikament |
|---|---|---|---|
| TPMT | *2,*3A, *3B,*3C | rs1800462, rs1800460, rs1142345 | Azathioprin, 6-Mercaptopurin, 6-Thioguanin |
| UGT1A1 | *28 | rs3064744 | Irinotecan |
| DPYD | *2A, *13, c.2846A>T, c.1236G>A | rs3918290, rs55886062, rs67376798, rs56038477 | 5-Fluorouracil, Capecitabin, Tegafur |
| MTHFR | c.677C>T, | rs1801133, rs1801131 | Methotrexat |
| CYP2C8 | *3 | rs11572080 | Paclitaxel |
*SNP (Einzelnukleotid-Polymorphismus)
Material
2 ml EDTA-Blut
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen.
Für die genetische Untersuchung benötigen wir die Einverständniserklärung des Patienten.
Abrechnung
Diese Untersuchungen werden bei gegebener Indikation von den privaten Krankenkassen erstattet.
Gesetzlich Versicherte können diese Leistungen als Selbstzahler anfordern.
(Ausnahmen im EBM: DPYD: GOP 32867; UGT1A1: GOP 32868)
Literatur
- Fachinformationen der Arzneimittel
- Swen et al. (2011): Pharmacogenetics: From Bench to Byte-An Update of Guidelines. Clinical pharmacology & Therapeutics 89(5):662-673.
- Deufel et al. (2004): Richtlinie: labormedizinische Diagnostik bei der Therapie mit TPMT (Thiopurin-S-Methyltransferase) -abhängigen Pharmaka. J Lab med 28(6):477-482.
- Lazar und Jetter (2008): Pharmakogenetik in der Onkologie: 5-Fluorouracil und die Dihydropyrimidin-Dehydrogenase. Dtsch Med Wochenschr. 133:1501-4.
- Cóte et al. (2007): UGT1A1 Polymorphism Can Predict Hematologic Toxicity in Patients Treated with Irinotecan. Clin Cancer Res 13(11): 3269-3275.
- Hider et al. (2007): The pharmacogenetics of methotrexate. Review. Rheumatology 46:1520–1524.
- Dai et al. (2001): Polymorphisms in human CYP2C8 decrease metabolism of the anticancer drug paclitaxel and arachidonic acid. Pharmacogenetics 11(7):597-607.
- ’The Pharmacogenomics Knowledgebase’ (https://www.pharmgkb.org/), Dosierungsempfehlungen anhand des Genotyps
- Positionspapier der DGHO: Dihydropyrimidin-Dehydrogenase (DPD) -Testung vor Einsatz von 5-Fluorouracil, Capecitabin und Tegafur, Juni 2020
- Rote Hand Brief: 5-Fluorouracil- (i.v.), Capecitabin- und Tegafur-haltige Arzneimittel, Juni 2020
- Rote Hand Brief: Irinotecan (UGT1A1-Langsammetabolisierer). Dezember 2021