Erhöhte Irinotecan-Toxizität bei reduzierter UGT1A1-Aktivität (Morbus Meulengracht)
Irinotecan (CPT11) ist ein Zytostatikum, das zur Behandlung des fortgeschrittenen kolorektalen Karzinoms und des kleinzelligen Lungenkarzinoms eingesetzt wird. Der aktive Metabolit von Irinotecan induziert zellzyklusabhängig einen „programmierten Zelltod“ (Apoptose) bei sich schnell teilenden Tumorzellen. Es hemmt selektiv das Enzym Topoisomerase I, welches am Kopiervorgang von DNA beteiligt und somit für die Bildung neuer Zellen essentiell ist. Durch die Blockade
werden die Tumorzellen daran gehindert, sich zu vermehren und sterben schließlich ab. Betroffen sind auch alle anderen Zellen, die sich schnell teilen (Schleimhautzellen).
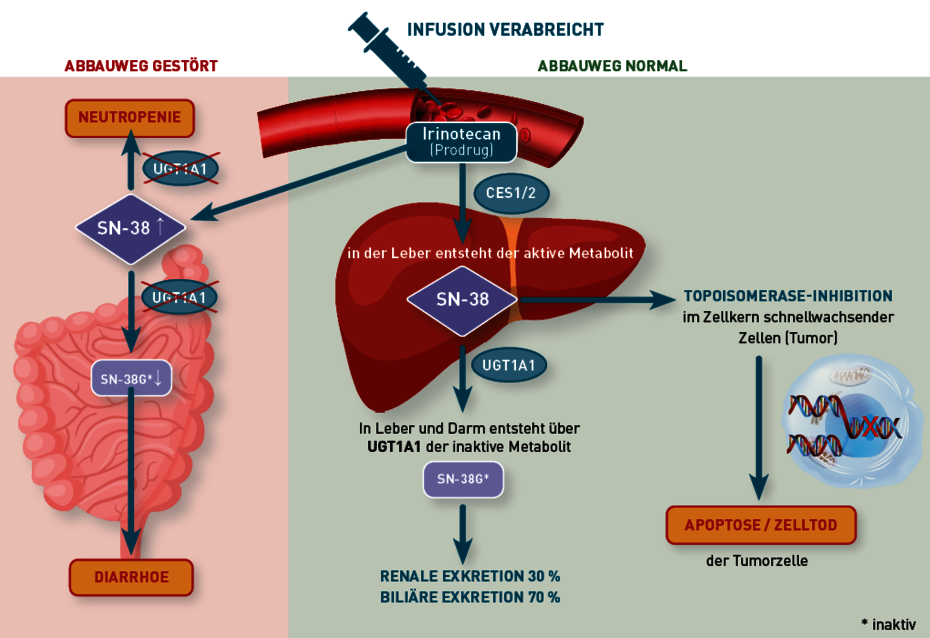
Vereinfachter Metabolismus von Irinotecan
Irinotecan ist ein Prodrug, das durch Carboxylesterasen (CES1/2) in Leber und Blut zu SN-38 aktiviert wird (Abb. 1). Dieser aktive Metabolit ist 100-fach zytotoxischer als Irinotecan selbst. SN-38 wiederum muss in Leber und Darm durch UGT1A1 (UDP Glucuronosyltransferase 1A1) zu SN-38-Glucuronid (SN-38G) inaktiviert werden, damit es hepatobiliär oder renal ausgeschieden werden kann. Verbleibt der aktive Metabolit SN-38 zu lange im Gastrointestinaltrakt, wird die Darmschleimhaut geschädigt, was zu schwerer Diarrhoe führen kann. Eine erhöhte Konzentration des aktiven Metaboliten im Blut hingegen führt zu schwerer Neutropenie.
UGT1A1-Genotyp hat Einfluss auf die Initialdosis von Irinotecan
Im UGT1A1-Gen sind zwei genetische Varianten bekannt, *6- und *28-Allel, die mit einer reduzierten UGT1A1-Enzymaktivität assoziiert sind. Die Umwandlung in den inaktiven Metaboliten SN-38G findet dann nur eingeschränkt statt.
Besonders Patienten, die durch Homozygotie oder kombinierte Heterozygotie der Allele *6 und *28 langsame UGT1A1-Metabolisierer (Poor Metabolizer PM) sind, haben durch die Akkumulation von SN-38 im Organismus ein erhöhtes Risiko, unter hohen Irinotecan Dosen schwere Nebenwirkungen wie Neutropenie und kaum behandelbare Diarrhoe zu entwickeln.
UGT1A1 ist das Hauptenzym für die Deaktivierung des zytotoxisch wirksamen Metaboliten SN-38
Abb. 1 Metabolismus von Irinotecan (stark vereinfacht)
Auf Empfehlung mehrerer Fachgesellschaften (ASCO, EMA, FDA, DPWG, BfArM) ist bei langsamen UGT1A1-Metabolisierern eine niedrigere Initialdosis indiziert. Bei guter Verträglichkeit können nachfolgende Dosen in Abhängigkeit von der Verträglichkeit und der Anzahl der neutrophilen Granulozyten erhöht werden. Intermediär-Metabolisierer haben zwar ein erhöhtes Risiko für Nebenwirkungen, können aber normale Initialdosen tolerieren (siehe Tab. 1).
Tab. 1 Übersicht der UGT1A1-Metabolisierertypen und Genotyp-basierte Dosisempfehlungen der „The Royal Dutch Pharmacists Association - Pharmacogenetics Working Group (DPWG)“
| Phänotyp | Genotyp | Enzymaktivität | Empfehlung Irinotecan | Frequenz Europäer |
|---|---|---|---|---|
| Normaler Metabolisierer (NM) | *1/*1 | normal | Therapiebeginn mit normaler Initialdosis | 13 % |
| Intermediärer Metabolisierer (IM) | *1/*6 *1/*28 | reduziert | Therapiebeginn mit normaler Initialdosis | 46 % |
| Langsamer Metabolisierer (PM) | *6/*6 *6/*28 *28/*28 | deutlich reduziert | Therapiebeginn mit 70% der Initialdosis, bei guter Verträglichkeit Dosissteigerung in Abhängigkeit der Neutrophilenzahl | 41 % |
Die UGT1A1-Genotypisierung hat bei homozygotem Nachweis reduzierter UGT1A1-Allele eine sehr hohe Spezifität in Hinblick auf das Auftreten sowohl von schwerer Neutropenie als auch von Diarrhoe.
Unabhängig davon können weitere Faktoren (z.B. seltene UGT1A1-Allele, Arzneimittelinteraktionen, Alter,…) Einfluss auf die Irinotecan-Verträglichkeit haben und es wird empfohlen, die in der Arzneimittel-Fachinformation aufgeführten Überwachungsmaßnahmen zu beachten.
UGT1A1 Substrate & Arzneimittelinteraktionen
UGT1A1 ist ebenfalls am Metabolismus nachfolgender Medikamente beteiligt: Sacituzumab govetican, Paracetamol, Opioide, nicht steroidale Antirheumatika (NSAR), Östrogene (Estradiol, Ethinylestradiol), Trizyklische Antidepressiva (TZA), Naloxon, Benzodiazepine, Lamotrigin, Ezetimib
Auch bei der parallelen Anwendung nachfolgend genannter Medikamente mit Irinotecan können Arzneimittelinteraktionen auftreten.
Wirkabschwächung von Irinotecan: Antiepileptika (Phenobarbital, Phenytoin, Carbamazin), Dexamethason, Johanniskraut
Wirkverstärkung von Irinotecan: Diuretika (Torasemid, Furosemid)
Indikation
Bestimmung der Initialdosis vor Beginn einer Therapie mit Irinotecan (Campto®) oder irinotecanhaltigen Arzneimitteln
wie Sacituzumab Govitecan (Trodelvy®)
(für die gesonderte Befunderstellung bitte auch die Indikation auf dem Anforderungsschein beachten; V.a. Morbus Meulengracht/Gilbert Syndrom)
Material
2 ml EDTA-Blut
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen. Für die genetische Untersuchung benötigen wir die Einverständniserklärung des Patienten.
Abrechnung
Eine Abrechnung im kassen- (GOP 32868) und privatärztlichen Bereich ist gegeben.
Literatur
- Rote Hand Brief Irinotecan (Bundesinstitut für Arzneimittel und Medizinprodukte BfArM))
- Fachinformation Campto® (Irinotecanhydrochlorid 3 H2O)
- Fachinformation Trodelvy® (Sacituzumab Govitecan)
- Dean (updated 2018): Irinotecan Therapy and UGT1A1 Genotype. Medical Genetics Summaries.
- Femke et al. (2018): Individualization of Irinotecan Treatment: A Review of Pharmacokinetics, Pharmacodynamics, and Pharmacogenetics. Clin Pharmacokinet. 57(10):1229-1254.
- Nelson et al. (2021): UGT1A1 Guided Cancer Therapy: Review of the Evidence and Considerations for Clinical Implementation. Cancers 13(7):1566.
- Fujii et al. (2018): Dose adjustment of irinotecan based on UGT1A1 polymorphisms in patients with colorectal cancer. Cancer Chemotherapy and Pharmacology 83(1):123-129.
- Takano and Sugiyama (2017): UGT1A1 polymorphisms in cancer: impact on irinotecan treatment. Pharmacogenomics and Personalized Medicine;10:61-68.
- ASCO American Society of Clinical Oncology
- EMA Europäische Arzneimittel-Agentur
- FDA Food and Drug Administration
- DPWG The Royal Dutch Pharmacists Association - Pharmacogenetics Working Group
- BfArM Bundesinstitut für Arzneimittel und Medizinprodukte