Autoantikörper gegen NEURONALE TRANSGLUTAMINASE 6 bei Verdacht neurologischer Manifestation der Glutenunverträglichkeit
Die Glutenunverträglichkeit umschließt alle Erkrankungen, die im Zusammenhang mit der Aufnahme glutenhaltiger Nahrung stehen. Dazu zählen die Zöliakie (glutensensitive Enteropathie), die Weizenallergie (allergische Reaktionen auf Weizenbestandteile) und die Glutensensitivität (alle übrigen nicht als Zöliakie oder Allergie diagnostizierten Störungen mit intestinalen und extraintestinalen Symptomen, die nach dem Verzehr glutenhaltiger Nahrungsmittel auftreten). Da Gluten über die Nahrung aufgenommen wird, werden bei einer Glutenunverträglichkeit meist gastroenterologische Symptome erwartet. Jedoch ist mittlerweile klar, dass sich die Glutenunverträglichkeit auch an weiteren Organen manifestieren kann. So zum Beispiel in der Haut (Dermatitis herpetiformis Duhring) oder im Gehirn (z.B. Gluten-Ataxie). Der Gastroenterologie und Dermatologie stehen neben der Bestimmung der Auto-Antikörper gegen Gewebetransglutaminase (anti-htTG/anti-TG2) oder Endomysium auch die Biopsie zur Diagnose der Zöliakie oder der Dermatitis herpetiformis Duhring zur Verfügung.
Bei neurologischen Erkrankungen ist die Möglichkeit der Biopsie jedoch ausgeschlossen.
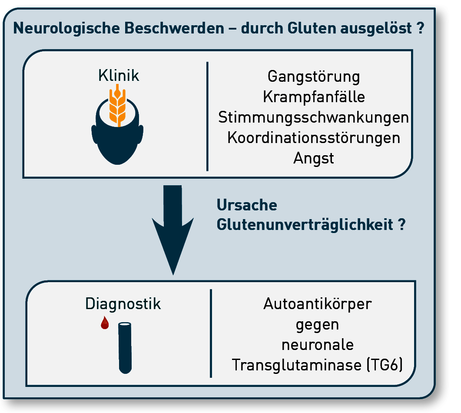
Die serologische Testung auf Antikörper gegen humane neuronale Transglutaminase 6 (TG6) eröffnet die Möglichkeit der Identifikation von Patienten mit einem erhöhten Risiko für neurologische Manifestationen einer Glutenunverträglichkeit (Abb. 1).
Abb. 1 Indikationen für die Bestimmung von TG6-Autoantikörpern
Pathogenese
Die Pathogenese der Gluten-induzierten neurologischen Krankheitsbilder ist noch nicht gänzlich geklärt. Die Patienten haben häufig eine abnorme MR-Spektroskopie des Kleinhirns und weisen Läsionen der weißen Substanz bzw. zerebelläre Atrophien auf.
Transglutaminase 6 (TG6), ein Mitglied der Transglutaminase-Familie von proteinvernetzenden Enzymen, ist eng verwandt mit Gewebstransglutaminase 2 (TG2, dem Autoantigen bei Zöliakie) und epidermaler Transglutaminase 3 (TG3, dem Autoantigen bei Dermatitis herpetiformis). Es wird angenommen, dass TG6 als Autoantigen bei glutenbedingten neurologischen Erkrankungen fungiert. Ablagerung von gegen TG6 gerichtetem IgA wurden beobachtet in Gefäßen aus Kleinhirngewebe von Gluten-Ataxie Patienten. TG6 wird im zerebellären Kortex (in Purkinje-Zellen), aber auch im Thalamus (motorischer Kontrollpunkt) exprimiert. Die bei den Patienten beobachtete signifikante Thalamusatrophie und Tendenz zur zerebellären Atrophie stehen daher im Einklang mit dem Verlust von TG6-Neuronen, die möglicherweise zu einer Beeinträchtigung der GABA-ergen inhibitorischen Bahnen führen.
TG6 in der Diagnostik gluten-assoziierter Erkrankungen
TG6-Autoantikörper bei gluten-assoziierter Zöliakie
Rund 1/4 der erwachsenen Zöliakiepatienten weisen neurologische Symptome auf. Anti-TG6 konnte bei bis zu 85 % der Zöliakiepatienten mit neurologischer Beteiligung nachgewiesen werden. Einerseits kann dies durch eine Kreuzreaktivität der TG2-Autoantikörper mit TG6 erklärt werden, andererseits entstehen auch direkt Autoantikörper gegen andere Mitglieder der Transglutaminase-Familie, insbesondere gegen TG6.
Besonders Patienten, die sich nicht strikt glutenfrei ernähren, bilden vermehrt Antikörper gegen TG6. Durch diese Nicht-Einhaltung der glutenfreien Diät (GFD) erhöht sich das Risiko für eine neurologische Manifestation der Glutenunverträglichkeit. Dabei steigt das Risiko mit der Dauer der Exposition gegenüber Gluten an. Die Untersuchung der TG6-Autoantikörper eignen sich, um Zöliakiepatienten mit einem Risiko für neurologische Erkrankungen zu identifizieren und sie so zu einer sehr strikten GFD zu motivieren, um möglichen neurologischen Begleiterkrankungen vorzubeugen.
TG6-Autoantikörper bei Glutensensitivität (NCGS)
Die Leitlinien und wir (Diagnostikinformation 162) empfehlen bei Verdacht auf Zöliakie primär die Testung der Patienten auf Autoantikörper gegen TG2. Etwa ein Drittel der symptomatischen Patienten, die negativ auf TG2 getestet wurden, haben jedoch isoliert Autoantikörper gegen andere Transglutaminasen gebildet. Die Prävalenz positiver TG6-Autoantikörper ist bei Patienten mit diagnostizierter Zöliakie oder NCGS vergleichbar. Auch ähneln sich in diesem Fall die dokumentierten neurologischen Symptome, die auch mit vergleichbarer Häufigkeit auftreten. Die Bestimmung von Autoantikörpern gegen TG6 liefert NCGS-Patienten eine klare Diagnose, die Möglichkeit einer gezielten Behandlung durch eine strikt glutenfreie Diät und verringert das Risiko für neurologische Erkrankungen.
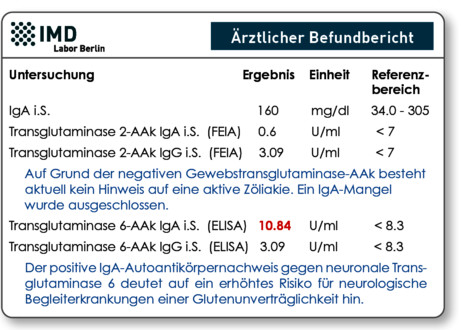
Abb. 2 Musterbefund: Auch bei negativen TG2-AAk deuten positive TG6-AAk auf einen, durch Gluten induzierten, autoimmunen Prozess hin.
TG6-Autoantikörper zur Diagnose der Gluten-Ataxie
Die Gluten-Ataxie (GA) macht 15 % aller Ataxien aus, betrifft insbesondere Patienten > 50 Jahre und ist gekennzeichnet durch ein allmähliches Auftreten von Gangataxie, verbunden mit peripherer Neuropathie. Gelegentlich kann sie schnell fortschreitend sein, ähnlich wie bei der paraneoplastischen zerebellären Degeneration. Bei entsprechendem Verdacht ist der Nachweis von Auto-Antikörpern gegen TG6 spezifisch für eine GA. Entsprechend wird diese Untersuchung auch von der Leitlinie für die Diagnostik und Behandlung progressiver Ataxien als sensitiver Marker für eine Gluten-induzierte Ataxie empfohlen. Bei positivem Testergebnis sollte auch bei fehlender Enteropathie eine strikt glutenfreie Diät erfolgen.
TG6-Autoantikörper zur Diagnose der Gluten-Neuropathie
Neben der Gluten-Ataxie kann auch eine Gluten-Neuropathie auftreten. Sie äußert sich in einer Schwäche der Extremitäten, Taubheitsgefühl oder Kribbeln bis hin zu neuropathischen Schmerzen in Händen und Füßen. Auto-Antikörper gegen TG6 dienen in diesem Fall der Diagnose der Gluteninduzierten Neuropathie. Auch in diesem Fall ist eine strikt glutenfreie Diät indiziert.
| Prävalenz von TG6-Autoantikörpern bei ausgewählten Erkrankungen | |
|---|---|
| Gluten-Ataxie | 73 % |
| Zöliakie-Patienten | 40 % |
| Zöliakie-Patienten mit nachgewiesen neurologischer Beteiligung | 85 % |
| NCGS-Patienten mit neurologischen Symptomen | 60 % |
| Zerebralparesen | 15 % |
| Schizophrenie (Zöliakie-AAk negativ) | 13 % |
| Gesunde | < 4 % |
Differentialdiagnosen behandelbarer Ataxien
Neben der Gluten-Ataxie gibt es weitere Ataxien, die behandelbar sind, daher ist die Diagnose dieser Erkrankungen ebenfalls wichtig und sollte differentialdiagnostisch berücksichtigt werden.
| Differentialdiagnosen behandelbarer Ataxien | |
|---|---|
| Ataxie-Auslöser | Diagnostik |
| Gluten | Transglutaminase 6-AAk im Serum |
| Vitamin B12-Mangel/ Autoimmungastritis | Gesamt-Vitamin B12, HoloTC, MMA, Parietalzell-/IntrinsicFaktor-AAk im Serum, Homocystein im Citrat-Plasma Diagnostikinformation 218 |
| Vitamin B1 Mangel/ Alkoholismus | B-Vitaminstatus bioaktiv Diagnostikinformation 307 |
| Vitamin E-Mangel/ Abetalipoproteinämie | Vitamin E im Serum (24H) LDL und VLDL im Serum |
| Zerebrotendinöse Xanthomatose | Cholestanol im Serum, CYP27A1-Mutation |
| Morbus Niemann-Pick Typ C (Lipidspeicherkrankheit) | Untersuchung des Cholesterol-Stoffwechsels, Neurogenetische Diagnostik auf NPC1 und NPC2 Gen |
| Vergiftung durch Alkohol, Medikamente (z.B. Phenytoin), toxische Metalle (Blei, Quecksilber!) | Medikamentenspiegel, B-Vitaminstatus bioaktiv Diagnostikinformation 307, Toxische Metalle im EDTA-Blut Diagnostikinformation 304 |
| Infektionen | Syphilis, Herpes Zoster, Eppstein-Barr-Virus, HIV, Borreliose |
| Paraneoplatische Syndrome | Internistische Diagnostik |
Material
neuronale Transglutaminase 6-AAk IgA und -IgG: 1 ml Serum
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen.
Abrechnung
Eine Abrechnung ist im kassen- und privatärztlichen Bereich gegeben.
Selbstzahler entnehmen die Kosten dem PDF-Dokument.
Literatur
- Al-Toma A, Volta, Auricchio et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. UEG J 2019 ; 7(5):583-613
- De Siva, Greenfield, Cook et al. Guidelines on the diagnosis and management of the progressive ataxias. Orphanet Journal of Rare Diseases 2019 ; 14:51
- Hadjivassiliou, Aeschlimann, Sanders et al. Transglutaminase 6 antibodies in the diagnosis of gluten ataxia. Neurology 2013 ; 80 (19):1740-5
- Hadjivassiliou, Rao, Grinewald et al. Neurological Dysfunction in Coeliac Disease and Non-Coeliac Gluten Sensitivity. Am J Gastroenterol 2016 ; 111(4):561-7
- Lionetti, Francavilla, Pavone et al. The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis. Dev Med child Neurol. 2010 ; 52:700-7007
- Zis, Rao, Sarrigiannis et al. Transglutaminase 6 antibodies in gluten neuropathy. Dig Liver Dis 2017 ; 49(11):1196-1200.
- Hadjivassiliou Croall Zis et al. Neurologic Deficits in Patients with Newly Diagnosed Celiac Disease Are Frequent and Linked With Autoantibodies to Transglutaminase 6. Clin Gastroenterol Hepatol. 2019 ; 17(13):2678- 2686