Autoantikörperbestimmung bei chronischem Fatigue-Syndrom (CFS)
Das chronische Fatigue-Syndrom (CFS), auch als Myalgische Enzephalomyelitis (ME) bezeichnet, ist eine häufige und schwere Multisystemerkrankung. Eine definierte Ursache konnte bisher nicht gefunden werden. Klar ist aber, dass bei ME/CFS Dysregulation des Immunsystems, des Hormonsystems, des autonomen Nervensystems und des zellulären Energiestoffwechsels auftreten.
In ca. 2/3 der Fälle wird das ME/CFS durch eine Infektion ausgelöst. Neben Erregern wie z.B. Epstein-Barr-Virus (EBV), Herpesviren, Enteroviren, Influenza, Dengueviren, Bakterien (Borrelien, Chlamydien, Legionellen, Coxiellen) sind weitere Auslöser möglich. So können z.B. ein HWS-Trauma, Operationen, Schwangerschaft, besonders körperliche Anstrengungen oder psychische Belastungen mit dem Krankheitsbeginn assoziiert sein.
Als Leitsymptom des ME/CFS gilt schwere Fatigue und Belastungsintoleranz. Das bedeutet eine verzögert auftretende (bis zu 48 Stunden) massive Verschlimmerung der Beschwerden auch schon nach geringer körperlicher oder geistiger Anstrengung (PEM = Post-Exertional Malaise). Diese Beschwerden können dann Tage bis Wochen andauern. Zusätzlich leiden die meisten Patienten unter Schmerzen, grippeähnlichen Symptomen und kognitiven Störungen, wie z.B. Konzentrations- und Gedächtnisprobleme, Sprachstörungen, Reizempfindlichkeit, Reizdarmbeschwerden und ausgeprägten Schlafstörungen. Auch eine Infektanfälligkeit und Allergieneigung wurden beschrieben. Weitere Informationen finden Sie auf der Webseite der Deutschen Gesellschaft für ME/CFS e.V. (https://www.mecfs.de).
Auch im Zusammenhang mit dem Coronavirus SARS-CoV-2 wurde beobachtet, dass ein Teil der Patienten Wochen bis Monate nach dem Infekt Beschwerden entwickeln, die als „Long-COVID“ oder „Post-COVID-19-Syndrom“ bezeichnet werden und an ME/CFS erinnern. Dazu zählen vor allem Fatigue, PEM und Brain Fog (kognitive Dysfunktion).
Pathomechanismus
Der zugrundeliegende Pathomechanismus bei ME/CFS ist noch nicht vollständig verstanden. Häufig wurde eine persistierende Immundysregulation beschrieben, gekennzeichnet durch Veränderungen der Zytokinprofile und des Immunglobulinspiegels (vermindert oder erhöht), des T- und B-Zell Phänotyps und einer verminderten Funktion der natürlichen Killerzellen. Weiterhin gibt es überzeugende Hinweise dafür, dass ME/CFS bei Patienten mit vorangegangener Infektion eine autoimmune Ätiologie aufweist, da auch Autoantikörper nachweisbar sind.
ME/CFS ist eine Ausschlussdiagnose
Um die klinische Verdachtsdiagnose CFS zu stellen, muss zunächst eine umfangreiche klinische und labordiagnostische Ausschlussdiagnostik betrieben werden. Zudem müssen die Kanadischen Konsensuskriterien (CCC) oder die Internationalen Konsenskriterien (ICC) für ME/CFS erfüllt sein. Die Diagnose ME/CFS darf erst gestellt werden, wenn die Symptome länger als 6 Monate andauern, da damit die postinfektiöse Fatigue abgegrenzt wird. Auch andere mit chronischer Fatigue einhergehende Erkrankungen müssen ausgeschlossen werden, z.B. Autoimmunerkrankungen, neurodegenerative Erkrankungen oder Krebs. Häufige komorbide Erkrankungen bei CFS sind Fibromyalgie, Reizdarm, Hashimoto Thyreoiditis und Endometriose.
Aktuell gibt es noch keine spezifischen Laborparameter, mit denen das Vorliegen eines ME/CFS sicher diagnostiziert werden kann.
Neurotransmitter-Rezeptor-Autoantikörper sind bei ca. 30% der Patienten mit ME/CFS nachweisbar
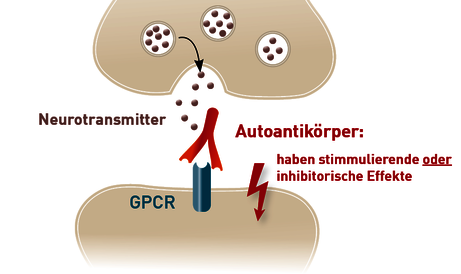
Von mehreren Gruppen wurden beim postinfektiösen ME/ CFS Autoantikörper (AAk) gegen verschiedene Antigene, einschließlich Neurotransmitter-Rezeptoren identifiziert. Neurotransmitter-Rezeptoren gehören zur Gruppe der G-Protein-gekoppelten Rezeptoren (GPCR). GPCR sind in Zellmembranen lokalisiert und für die Wahrnehmung und Weiterleitung extrazellulärer Reize ins Zellinnere verantwortlich. Sie lösen dadurch biochemische Signalkaskaden in der Zelle aus. AAk, die sich gegen GPCR richten, können nach Bindung an ihre jeweiligen Rezeptoren sowohl agonistisch als auch antagonistisch wirken (Abb. 1).
Abb. 1 Autoantikörper (AAk) gegen G-Protein-gekoppelte Rezeptoren (GPCR) spielen eine pathogene Rolle bei mehreren Autoimmunerkrankungen.
Da sie in Folge der Rezeptorbindung die Funktion der Zielzellen verändern, zählen sie zu den sogenannten funktionellen AAk. Sie gehören zu einem regulatorischen Netzwerk, das bei zahlreichen Erkrankungen dysreguliert ist und somit an der Pathogenese verschiedener Autoimmun- und NichtAutoimmunerkrankungen beteiligt ist.
So spielen AAk gegen Neurotransmitter-Rezeptoren, wie β-adrenerge Rezeptoren und muskarinerge AcetylcholinRezeptoren (mAChR) auch bei ME/CFS eine Rolle. Schon 2003 konnte gezeigt werden, dass erhöhte Konzentrationen an AAk gegen mAChR nachweisbar sind und diese mit Muskelschwäche und neurokognitiven Störungen korrelierten. In einer Studie der Arbeitsgruppe um Frau Prof. Scheibenbogen fanden sich bei einem Teil der ME/CFS-Patienten im Vergleich zu Gesunden signifikant erhöhte AAk gegen β-adrenerge Rezeptoren und muskarinerge AcetylcholinRezeptoren.
Auch bei Long-COVID konnten zahlreiche AAk nachgewiesen werden, unter anderem gegen verschiedene G-Proteingekoppelte Rezeptoren. Laufende Studien dazu werden zeigen, ob diese GPCR-AAk z.B. ursächlich für die Symptompersistenz sind.
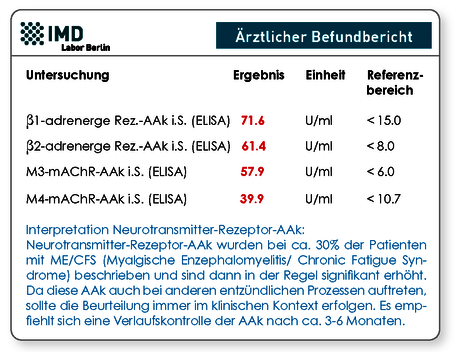
Die Tests zur quantitativen Bestimmung der AAk gegen β1-/ β2-adrenerge Rezeptoren und M3-/M4-muskarinerge Acetylcholin-Rezeptoren (mAChR) stehen in unserem Labor zur Verfügung. Positive AAk-Befunde können unterstützend zur Diagnosestellung von ME/CFS herangezogen werden, gelten jedoch nicht als beweisend. Unauffällige AAk-Befunde jedoch schließen das Vorliegen von ME/CFS auch nicht aus, da nur ca. 30% der Patienten Neurotransmitter-RezeptorAAk vorweisen (Abb. 2 und 3).
Abb. 2 Musterbefund mit deutlich erhöhten AAk-Konzentrationen | Abb. 3 Musterbefund ohne Nachweis erhöhter AAk-Konzentrationen
Material und Abrechnung
Neurotransmitter-Rez.-AAk: 0,5 ml Serum od. 10 ml Vollblut
Der Transport ins Labor ist nicht zeitkritisch.
Eine Abrechnung ist gegenwärtig nur im privatärztlichen Bereich (GOÄ) gegeben. Selbstzahler entnehmen bitte die aktuellen Untersuchungspreise dem PDF-Dokument.
Literatur
- Loebel et al. Antibodies to b adrenergic and muscarinic cholinergic receptors in patients with Chronic Fatigue Syndrome. Brain, Behavior, and Immunity 52 (2016) 32–39.
- Scheibenbogen et al. Immunoadsorption to remove ß2 adrenergicrecep - tor antibodies in Chronic Fatigue Syndrome CFS/ME (2018). PLoS ONE 13(3): e0193672.
- Sotzny et al. Myalgic Encephalomyelitis/Chronic Fatigue Syndrome Evidence for an autoimmune disease. Autoimmunity Reviews 17 (2018) 601– 609.
- Scheibenbogen et al. Chronisches Fatigue Syndrom/CFS. Praktische Empfehlungen zur Diagnostik und Therapie. Der niedergelassene Arzt (2020)
- Grabowski P, Scheibenbogen C. Chronisches Fatigue-Syndrom. Harrisons Innere Medizin, ABW Wissenschaftsverlag (2016)
- Bynke et al. Autoantibodies to beta-adrenergic and muscarinic cholinergic receptors in Myalgic Encephalomyelitis (ME) patients – A validation study in plasma and cerebrospinal fluid from two Swedish cohorts. Brain Behav Immun Health. 2020 Aug; 7: 100107
- Dragun et al. Autoimmune mediated G-protein receptor activation in cardiovascular and renal pathologies. Thromb. Haemost. 2009, 101, 643–648.
- Tanaka et al. Autoantibodies against muscarinic cholinergic receptor in chronic fatigue syndrome. Int. J. Mol. Med. 2003
- Cabral-Marques et al. GPCR-specific autoantibody signatures are associated with physiological and pathological immune homeostasis. Nat Commun. 2018; 9: 5224.
- Nacul, L.; Authier, F.J.; Scheibenbogen, C.; Lorusso, L.; Helland, I.B.; Martin, J.A.; Sirbu, C.A.; Mengshoel, A.M.; Polo, O.; Behrends, U.; et al. European Network on Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (EUROMENE): Expert Consensus on the Diagnosis, Service Provision, and Care of People with ME/CFS in Europe. Medicina 2021, 57, 510.