Der quantitative zelluläre Immunstatus − Indikationen und Interpretation
Der quantitative zelluläre Immunstatus gibt Auskunft über die numerischen Verhältnisse, den Aktivierungszustand und Reifungsgrad der Immunzellen im Blut und ist indiziert, falls die klinische Symptomatik eines Patienten primäre oder sekundäre Störungen im zellulären Immunsystem vermuten lässt.
Die Grundstruktur des üblicherweise verwendeten quantitativen zellulären Immunstatus erinnert noch sehr an dessen originäres Anwendungsgebiet, das Monitoring von HIV-infizierten
Patienten. Ende der 80er Jahre wurde die Zelltypisierung anhand von CD-Oberflächenmarkern (Zytofluorometrie, FACS) für diese Fragestellung entwickelt. Für die Anwendungsfelder sekundärer Immundefekte oder chronische Infektionen waren Standardprofile wenig aussagefähig. Durch Etablierung neuer Immunmarker hat der quantitative zelluläre Immunstatus inzwischen für zahlreiche weitere Erkrankungen Bedeutung erlangt. Dazu zählen primäre und sekundäre Immundefizienzen einschließlich solcher, die im Rahmen von Tumorerkrankungen, chronischen Infektionen oder Autoimmunerkrankungen auftreten.
Für eine adäquate Immunabwehr sind eine Mindestmenge an Granulozyten und Monozyten (unspezifische Abwehr) sowie an T-Lymphozyten (CD4-, CD8-), B-Zellen und NK-Zellen notwendig. Die Bewertung der Zellzahlen sollte immer unter Berücksichtigung klinischer Gesichtspunkte (z.B. durchgeführte therapeutische Maßnahmen) und nach dem Verlauf erfolgen, da geringfügige Normabweichungen häufig auch beim Gesunden auftreten. Während die Quantifizierung der CD4-, CD8-, B- und NK-Zellen, die Bestimmung der aktivierten T-Zellen sowie die Verschiebungen der T-Zellsubpopulationen (v.a. CD4/CD8-Ratio; Naive/Memory-T-Zellen) von allgemeinem Interesse sind, stehen heute krankheitsspezifische und somit indikationsbezogene Marker zur Verfügung, was sich in dem Angebot verschiedener Profile widerspiegelt
Aussagen zur Funktionalität der Zellen sind jedoch nur bedingt möglich. Der quantitative zelluläre Immunstatus ersetzt weiterhin nicht die Funktionsteste (LTT-Immunfunktion, NK-Zell-Zytotoxizitätstest, Granulozytenfunktion). Einen ersten Hinweis auf die Reaktionsfähigkeit der T-Zellen stellen allerdings der zelluläre Aktivierungsgrad (Anzahl HLA-DR+ oder CD25+ T-Zellen), die Zahlen von antigen-unerfahrenen Zellen (CD8+ Naive-Zellen) und antigen-erfahrene Zellen (CD8+ Zentral Memory-, Effektor Memory- und Terminale Effektor-Zellen) dar. Die Analyse dieser Zellpopulationen dient dazu, das Ausmaß der T-zellulären Aktivierung im Rahmen von Immunprozessen z.B. bei Virusinfektionen, Autoimmunerkrankungen, Sarkoidose, Transplantatrejektionen und einigen Malignomen zu bestimmen. Dabei muss berücksichtigt werden, dass aktivierte Zellen nur zum Teil erfasst werden, da sie die Blutbahn verlassen, um an den „Ort des Geschehens“ zu gelangen.
Interpretation des quantitativen zellulären Immunstatus
Der quantitative zelluläre Immunstatus gibt Auskunft über die Leukozytenzahl sowie über relative und absolute Zahlen der Lymphozyten und derer Subpopulation im Blut. Interpretiert werden gewöhnlich die Absolutzahlen (Zellen/µl) bzw. das Verhältnis zueinander (Ratio), mit Ausnahme der Aktivitätsbeurteilung (z.B. HLA-DR+ & CD25+) sowie der TregZellen und der CD31+ Thymusreserve. und der Treg-Zellen, wo hauptsächlich der prozentuale Anteil betrachtet wird. Nachfolgend sind die wichtigsten, im quantitativen zellulären Immunstatus erfassten Zellpopulationen und die häufigsten Ursachen für Abweichungen aufgeführt.
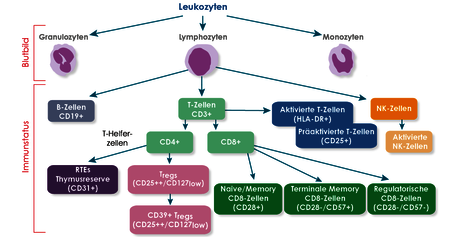
Abb. 1 Übersicht der diagnostisch relevanten Leukozytenpopulationen im peripheren Blut
Aktivierte T-Zellen [CD3+]
CD25+ Anstieg nach 1,5-2 Tagen, Abfall nach 4-6 Tagen
HLA-DR+ Anstieg nach 2-4 Tagen, anhaltend erhöht
CD25+ T-Lymphozyten sind präaktivierte T-Zellen. CD25 ist die alpha-Kette des Interleukin-2-Rezeptors. Seine Expression auf T-Lymphozyten zeigt an, dass diese T-Zellen das IL-2-Signal erwarten, um zu proliferieren. HLA-DR+ T-Zellen sind postmitotische Effektorzellen mit eingeschränkter Lebensdauer (wichtigster Aktivierungsmarker auf Blutzellen).
Anstiege sind Zeichen für Aktivierung des zellulären Immunsystems z. B. bei:
- Virusinfektion, Infektionen mit intrazellulären Erregern und Parasiten
- aktive Phasen einer Autoimmunerkrankung („akuter Schub“)
- Malignome (oft auch Therapieziel bei immunstimulierenden Therapien)
- T-Zell-Lymphome („Lymphomzellen sind fast immer aktiviert“)
- Organrejektion bei transplantierten Patienten
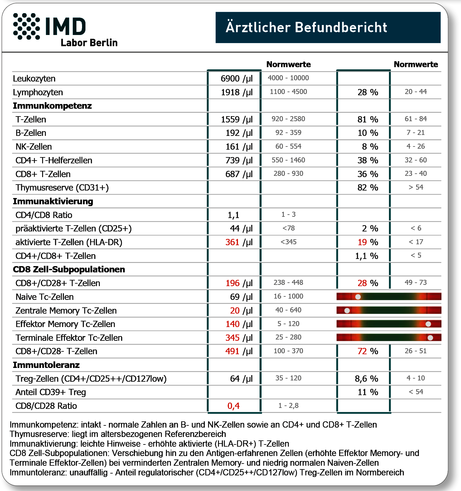
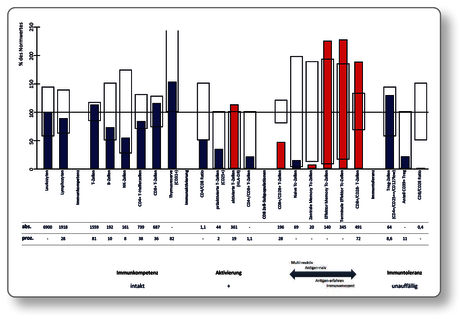
Da eine routinemäßig durchgeführte Analyse aller Marker zu kostenaufwendig und sogar verwirrend wäre, empfiehlt sich die indikationsbezogene Analyse in ausgewählten Profilen.
| Quantitative Immunprofile zur Lymphozytendifferenzierung | |
|---|---|
| Basisprofil | T-, NK-, B-Zellen, CD4+, CD8+, Ratio, Naive und Memory T-Zellen, aktivierte T-Zellen |
| Profil Immunkompetenz | T-, NK-, B-Zellen, CD4+, CD8+, Ratio, CD8-Subpopulationen (Naive, Memory, Effektor), präaktivierte & aktivierte T-Zellen, CD31-Thymusreserve, Treg-Zellen (inkl. CD39+) |
| Lymphom-Screening /-Typisierung | Suche nach lymphoproliferativen Erkrankungen (Lymphome) der T-, B- und NK-Zell-Reihe (polyklonale vs. monoklonale Vermehrung) anhand der WHO-Klassifikation 2016 (nähere Informationen in der Diagnostikinformation Nr. 165). |
| Profil Immundefekt | T-, B-, NK-Zellen, CD4+, CD8+, Ratio, CD4 und CD8-Subpopulationen (Naive, Memory, Effektor), CD31-Thymusreserve, aktivierte T-Zellen, B-Zellsubpopulationen (Transitional, Naive, Memory und Plasmazellen inkl. IgD, IgM, IgG1-4 und IgA1-2 sowie CD21low-Anteil) |
Indikationen für eine Lymphozytentypisierung
- Nachweis und Verlaufsbeobachtung von sekundären Immundefekten bei und nach Infektionen sowie bei Tumorerkrankungen
- bei auffälliger Lymphozytose (zum Nachweis oder Ausschluss einer immunproliferativen Erkrankung) oder bei persistierender Lymphozytopenie
- Statuserhebung sowie Verlaufskontrollen bei Tumorerkrankungen vor und während der Therapie
- Verlaufsbeobachtung von Autoimmunerkrankungen
- Diagnostik und Therapiemonitoring von persistierenden (HIV, HBV, HCV) und atypisch verlaufenden latenten Virusinfektionen (v.a. CMV, EBV, HHV-6) sowie chronifizierten bakteriellen Infektionen (z.B. Borrelien, Chlamydien)
- gehäufte oder prolongierte Infekte, chronisch rezidivierende Lokalinfektionen (Verdacht auf verminderte Infektresistenz)
- Wundheilungsstörungen
Methodik
Die Immunphänotypisierung des Blutes beruht auf der selektiven Erkennung von Zelloberflächenantigenen durch Fluoreszenzfarbstoffmarkierte, monoklonale Antikörper mittels Zytofluorometrie (FACS). Zur Quantifizierung der Lymphozyten-Subpopulationen dienen Antikörper gegen zelluläre Antigene, die linienspezifisch und relativ konstant exprimiert werden (z.B. CD3 für T-Zellen, CD19 für B-Zellen, CD16/56 für NK-Zellen usw.). Andere, variabel exprimierte Antigene geben uns Auskunft über den Aktivierungszustand der Zellen (z.B. HLA-DR oder CD25 auf aktivierten Effektor-T-Lymphozyten).
Wichtig!
Der quantitative zelluläre Immunstatus gibt keine Auskunft über die Funktionsfähigkeit der Zellpopulationen, da auch normale Zellzahlen einen funktionellen Immundefekt nicht ausschließen. Bei der Fragestellung nach einem „funktionellen Immundefekt“ sollten auch die Funktionsteste (z.B. LTTImmunfunktion, NK-Funktionstest, Granulozytenfunktion) in Erwägung gezogen werden.
Laboranforderung und Abrechnung
Die Laboranforderung erfolgt unter Benennung des gewünschten Profils (siehe Tabelle) entweder auf dem Anforderungsschein „Spezielle Immundiagnostik“ oder bei GKVVersicherten auf dem GKV-Laboranforderungsschein. Bitte vermerken Sie dort z.B. „Profil Immunkompetenz“.
Die Kosten für den quantitativen zellulären Immunstatus werden von der GKV sowie von Privatkassen übernommen.
Material
2 ml EDTA-Blut
Ein Probeneingang im Labor innerhalb von 24 Stunden (24h) muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden.
Innerhalb der Berliner Stadtgrenzen bieten wir Ihnen unseren Fahrdienst an (+49 (0)30 77001-250), für überregionale Abholungen kontaktieren Sie bitte den kostenfreien Kurierservice unter +49 (0)30 77001-450.
Hinweis
Zu den Markern CD31-Thymusreserve und regulatorische CD4 T-Zellen (Treg) verweisen wir auch auf unsere ausführlichen Diagnostikinformationen (Nr. 233 bzw. 239). Das Immunmonitoring bei Tumorpatienten ist in der Diagnostikinformation 251 beschrieben.
Literatur
- Kilpatrick RD et al. Homeostasis of the naive CD4+ T cell compartment during aging. J Immunol. 2008;180:1499-507.
- Odendahl M et al. Disturbed peripheral B lymphocyte homeostasis in systemic lupus erythematosus. J Immunol. 2000; 165:5970-9.
- Gallimore AM et al. Positive and negative influences of regulatory T cells on tumour immunity. Oncogene. 2008;27:5886