Diagnostik der Zöliakie
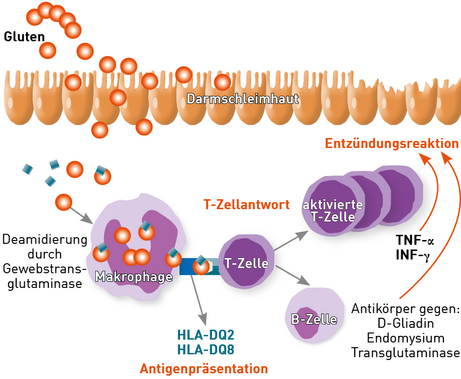
Die Zöliakie ist eine Autoimmunerkrankung, die durch Gluten ausgelöst wird. Sie tritt bei genetisch prädisponierten Personen auf und führt zu einer lebenslangen glutensensitiven Enteropathie. Es handelt sich somit nicht um eine Allergie. Das Autoantigen bei der Zöliakie ist die Gewebstransglutaminase des Dünndarms, im Komplex mit dem über die Nahrung aufgenommenen Gluten. Da nur die HLA-Moleküle DQ2 oder DQ8 die Gliadinfragmente des Glutens binden und dem Immunsystem präsentieren, können auch nur Träger dieser HLA-Merkmale erkranken. Die Erkrankung ist mit einer Prävalenz von 1:200 bis 1:500 nicht selten.
Abb. 1 Zöliakie ist eine, durch Gluten ausgelöste, autoimmune Enteropathie bei Patienten mit HLA-DQ2/DQ8
Diagnostik
Das Spektrum der Zöliakie-Diagnostik umfasst serologische, genetische und histologische Untersuchungen.
Antikörper im Serum bei Verdacht auf aktive Zöliakie
Sehr sensitive serologische Antikörpernachweise ermöglichen nicht nur die Diagnose der Zöliakie, sondern eignen sich auch zur Verlaufskontrolle. Folgende Antikörperbestimmungen stehen zur Verfügung:
- Antikörper gegen Gewebstransglutaminase IgG/IgA
- Antikörper gegen Endomysium IgG/IgA
- Antikörper gegen deamidiertes Gliadin IgG/IgA
Endomysium- und Transglutaminase-IgA-Ak sind sehr spezifische Marker für das Vorliegen einer Zöliakie, und mit der Kombination dieser zwei Assays lässt sich eine hohe Sensitivität (~100%) und Spezifität (~100%) in der ZöliakieDiagnostik erreichen. Daran sollte gedacht werden: Ô Bis zu 6% der Zöliakiepatienten haben einen IgA-Mangel. In diesen Fällen sind die IgA-Ak-Bestimmungen falsch negativ und können deshalb nicht zur Beurteilung herangezogen werden. Daher sollte das Gesamt-IgA immer parallel bestimmt werden. Bei bekanntem IgA-Mangel sollte die Bestimmung der jeweiligen IgG-Ak erfolgen. Die zusätzliche Untersuchung auf die IgG-Ak gegen deamidiertes Gliadin maximieren die diagnostische Sensitivität.
→ Unter glutenfreier Kost fallen die Antikörper-Titer ab.
Daher ist es essentiell, dass die erste Diagnosestellung unter glutenhaltiger Ernährung erfolgt. Im Behandlungsverlauf empfiehlt sich hingegen eine jährliche Kontrolluntersuchung zur Überwachung der glutenfreien Diät. Gluten kann ebenfalls in unerwarteten Produkten (z.B. Getränke) vorkommen, so dass ein erhöhtes Risiko für Diätfehler besteht.
Ausschluss einer Zöliakie mittels HLA-Bestimmung
Die HLA-Merkmale DQ2 und DQ8 sind eine zwingende Voraussetzung für eine Zöliakie, 100 % der Zöliakie-Patienten tragen eines dieser Merkmale. Das Auftreten einer Zöliakie ist unmöglich bei Patienten, die diese HLA-Merkmale nicht tragen. Die Untersuchung am IMD erfasst alle laut Literatur bekannten HLA-DQ2/DQ8 - Haplotypen (auch die sehr seltenen!), die mit einer Zöliakie einhergehen können. Ein negatives Ergebnis schließt eine Zöliakie daher 100%ig aus. Die HLA-Bestimmung wird nicht durch Diätmaßnahmen beeinflusst.
Leitlinien-gerechte Testalgorithmen
Bei den diagnostischen Algorithmen unterscheiden die Leitlinien zwischen:
- Klinischer Verdacht auf aktive Zöliakie
- Prophylaktische Kontrolle von Zöliakie-Risikopatienten.
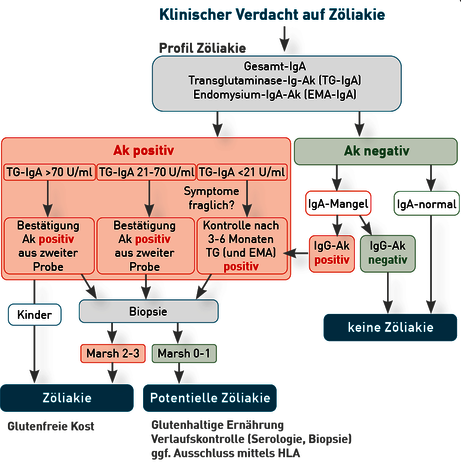
Klinischer Verdacht auf aktive Zöliakie
Das klinische Bild einer Zöliakie ist vielfältig und beschränkt sich nicht auf Symptome des Magen-Darm-Traktes. Bei folgenden Symptomen ist ebenfalls der Ausschluss einer aktiven Zöliakie empfohlen:
Migräne, Ataxie, generelle Abgeschlagenheit/Apathie, Zahnschmelzhypoplasie, Eisenmangel-Anämie, Reizdarmsyndrom, usw. (siehe Tabelle 1 und Abb. 2).
Tab. 1 Komorbiditäten, bei denen eine Zöliakie-Abklärung sinnvoll ist
| Komorbiditäten – Indikation für Antikörperbestimmung | |
|---|---|
| Dermatitis herpetiformis | Infertilität |
| Osteoporose | Zahnschmelzhypoplasie |
| IgA-Nephropathie | Alopecia areata |
| Eisenmangel-Anämie | Migräne |
| Malabsorption (Mikronärstoffe) | Ataxie |
| Transaminasenerhöhungen | Neuropathien |
| Reizdarmsyndrom | Depression/Angststörung |
| Morbus Crohn / Colitis Ulcerosa | |
Abb. 2 Diagnostisches Vorgehen nach den ESPGHAN-Kriterien 2020 und der S2k-Leitlinie 2014 bei Verdacht auf aktive Zöliakie
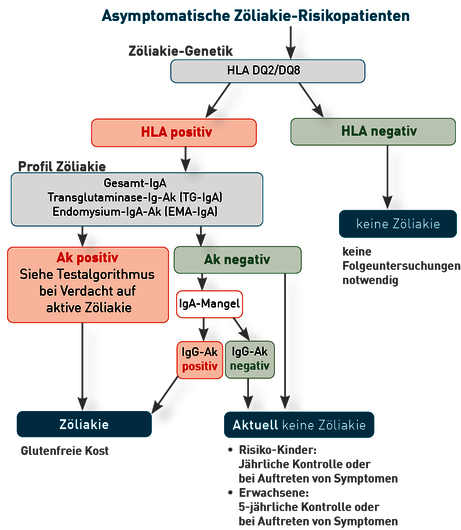
Kontrolle von Zöliakie-Risikopatienten
Verwandte ersten Grades von Zöliakie-Erkrankten oder Patienten mit bestimmten Autoimmunerkrankungen oder einem selektiven IgA-Mangel haben ein erhöhtes Risiko, eine Zöliakie zu entwickeln. In diesen Fällen sollte das Screening mit der HLA-Bestimmung beginnen, da bei einem negativen HLA-Ergebnis die regelmäßigen Screenings auf die Antikörper nicht mehr notwendig sind. Bei HLA-DQ2/8-Positivität sollten regelmäßig (bei auftretenden Symptomen oder bei asymptomatischen Kindern jährlich und asymptomatischen Erwachsenen alle 5 Jahre) die Transglutaminase-Ak bestimmt werden (Tabelle 2 und Abb. 3).
Abb. 3 Diagnostisches Vorgehen bei asymptomatischen Zöliakie-Risikopatienten nach den ESPGHAN-Kriterien 2020 und der S2k-Leitlinie 2014
Tab. 2 Risikofaktoren, bei denen eine Zöliakie-Abklärung sinnvoll ist
| Zöliakie-Risikofaktoren für HLA Bestimmung |
|---|
| Verwandte 1. Grades von Zöliakie-Erkrankten |
Genetische Syndrome
|
Immundefekt
|
Bekannte Autoimmunerkrankung
|
Material
Serologie: 5 ml Serum
Anforderungsempfehlung: Zöliakie-Antikörper Profil (Transglutaminase IgA, Endomysium IgA, gesamt-IgA)
HLA-Genotypisierung: 2 ml EDTA-Blut
Anforderung: HLA bei Verdacht auf Zöliakie
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen. Für die genetische Untersuchung benötigen wir die Einverständniserklärung des Patienten. Das Blutentnahme- und Versandmaterial wird vom Labor kostenfrei zur Verfügung gestellt.
Abrechnung
Eine Abrechnung ist bei gegebener Indikation im kassen- und privatärztlichen Bereich gegeben.
Sie wollen sich einen Vortrag dazu ansehen?
Zu diesem Thema steht Ihnen in unserem Videoarchiv ein Übersichtsvortrag zur Verfügung. Der Zugang ist ohne Anmeldung und kostenfrei möglich.
Literatur
- Al-Toma et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterol J 2019 ; 7(5):583-613
- Husby et al. European Society for Pediatric Gasroenterology, Hepatology, and Nutrition guidelines for diagnosing coeliac disease 2020. J Pediatr Gastroenterol Nutr. 2020; 70(1):141-156.
- Felber et al.: S2k-Leitlinie Zöliakie 2014, AWMF-Register-Nr. 021/021.
- Brown et al. A Clinician’s Guide to Celiac Disease HLA Genetics. Am J Gastroenterol 2019; 114: 1587-1592