Indikation und Interpretation der SARS-CoV-2-Antikörperdiagnostik
Die Bestimmung von Antikörpern gegen SARS-CoV-2 im Serum ersetzt nicht den Virus-Direktnachweis mittels PCR. Dieser direkte Erregernachweis bleibt für den Nachweis der akuten Infektion der Goldstandard. Es stehen aber mittlerweile für die Labordiagnostik (im Unterschied zum sehr unübersichtlichen Markt der Schnelltests) sehr sensitive und ausreichend spezifische Antikörpertests zur Verfügung. Für den Nachweis von Antikörpern gegen SARS-CoV-2 unterscheidet man zwei Indikationen:
1. Zum akuten Infektionsnachweis in Ergänzung des PCR-Direktnachweises
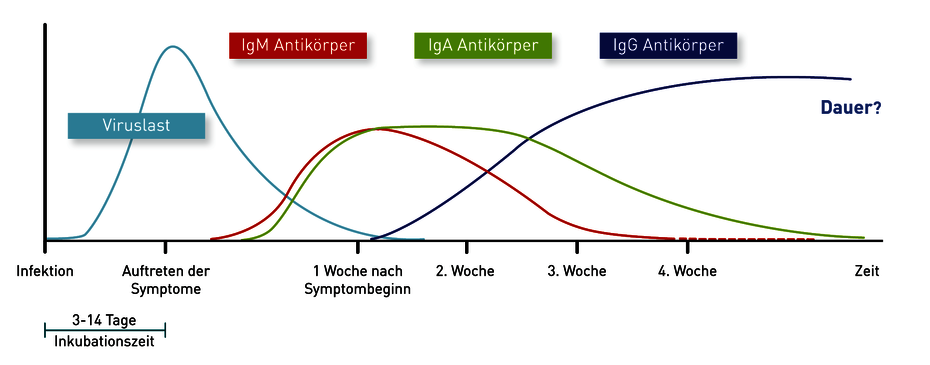
Wie Abb. 1 zeigt, fällt die Viruslast bereits wenige Tage nach dem Auftreten der ersten Symptome wieder ab. Die Sensitivität des direkten Infektionsnachweises mit der PCR geht damit einhergehend ab dem 7. Tag signifikant zurück. Das erklärt, warum in der Frühphase, also ab ca. 1 Woche nach Auftreten der Symptome, der Nachweis von IgM- oder IgA-Antikörpern im Blut die Sensitivität der Infektions- diagnostik signifikant erhöht (Guo L, Clin Infect Dis. 2020; Zhao J, Clin Infect Dis. 2020).
Abb. 1 Verlauf der Antikörperantwort in zeitlichem Bezug zur Viruslast und zum Zeitpunkt des Symptomeintritts
IgM und IgA sind frühe Antikörper
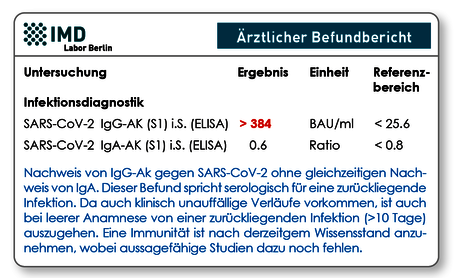
Die typische Konstellation für eine akute bzw. kürzlich erfolgte Infektion wäre IgM/IgA-positiv, IgG-(noch)negativ (siehe Abb. 2). Die in Deutschland üblicherweise verwendeten Tests detektieren meist entweder IgA oder IgM zusätzlich zum IgG. Unsere Erfahrung bei paralleler Anwendung dieser Tests zeigt, dass IgM ca. 2 Tage früher positiv ist, IgA dafür aber länger positiv bleibt, so dass beide Varianten Vor- und Nachteile zeigen, sich aber keine unterschiedlichen Interpretationen ergaben.
Abb. 2 Typischer Antikörperbefund bei frischer Infektion
2. Nachweis von Antikörpern zum Nachweis einer durchgemachten Infektion
Die zweite Indikation der Antikörperdiagnostik ist die Klärung, ob eine SARS-CoV-2-Infektion bereits durchgemacht wurde. Dafür ist vor allem das IgG von Bedeutung, welches sich erst im Verlauf der fortgeschrittenen Immunantwort nach Virus-Erstkontakt bildet und wie bei anderen Viren sehr lange, evtl. sogar dauerhaft persistiert (siehe Abb. 1). Ca. 6 Wochen nach erfolgter Infektion zeigen 94 - 98 % der Betroffenen IgG-Antikörper. Die parallele Messung des IgA kann dennoch sinnvoll sein, da auf diese Weise auch Fälle mit verzögerter IgG-Bildung (Phänomen der späten IgG-Bildung bei milder Symptomatik!, siehe Abb.1) erfasst werden können.
Abb. 3 Antikörperbefund bei abgelaufener (früherer) Infektion
Die Sensitivität der Antikörpertests hängt vom Untersuchungszeitpunkt ab
Die Bildung von IgM beginnt am 3. bis 4. Tag nach Symptomeintritt. Bei ca. 90 % der Infizierten ist IgM sieben Tage nach Symptombeginn im Serum nachweisbar. Verschiedene Studien sagen aus, dass nach 2 Wochen 100 % der Patienten messbare IgM-Titer haben (Xiao AT, I Infect 2020).
Andere Autoren berichten, dass bei 10 % zu keinem Zeitpunkt der Infektion IgM nachweisbar war (Padoan A, Clin Chem Lab Med 2020). Wie lange das IgM im Blut persistiert, scheint von der Sensitivität des verwendeten Testkits abhängig zu sein. Einige Autoren geben an, dass der Höhepunkt der IgM-Bildung in der 2. Woche erreicht wird (Sun B, Emerg Microbes Infect 2020), andere Studiengruppen haben beobachtet, dass IgM erst nach 4 Wochen wieder abfällt (Xie J, J Med Virol. 2020).
IgA wird 3-6 Tage nach Symptombeginn im Serum messbar (Guo L, Clin Infect Dis 2020). Es kommt im Vergleich zum IgM nur geringfügig später, persistiert dafür aber länger und kann somit in einigen Fällen die „Lücke“ zum IgG schließen. Das IgA ist früher positiv im Vergleich zum IgG (Jääskeläinen AJ Euro Surveill 2020). 7 Tage nach Symptombeginn zeigen ca. 50 % der Patienten IgA-Spiegel, nach 14 Tagen sind es 95 % (Herstellerangaben Euroimmun). Im Vergleich zum IgG zeigt sich in den ersten 10 Tagen (Frühphase der Infektion) eine höhere Sensitivität (Okba N, Emerg Infect Dis. 2020). Wie das IgM kann auch IgA in Einzelfällen über viele Wochen persistieren (Padoan A Clin Chem Acta 2020).
Die Bildung von IgG beginnt 7-10 Tage nach Auftreten der ersten Symptome. In der ersten Woche liegt die Sensitivität bei nur ca. 30 %. Ab der 3. Woche erreicht IgG eine Sensitivität von etwa 94 % (Herstellerangaben Euroimmun). In nahezu allen publizierten Studien gab es Fälle, wo trotz PCR-gesicherter Infektion auch nach mehreren Wochen keine IgGAntikörper auftraten. Die Häufigkeit dieser Seronegativität liegt unter 5 %.
Die Dynamik der Antikörperbildung ist in allen drei Klassen sehr individuell. Die angegebenen Zeiten können daher nur Mittelwerte abbilden.
Die Spezifität der Antikörpertests
Wie sicher ist es, dass man bei Nachweis von IgG die Infektion tatsächlich durchgemacht hat?
Diese Frage und die Begriffe Spezifität und positiver prädiktiver Wert werden aktuell in Fachkreisen, aber auch Medien, heftig diskutiert. Die diagnostische Spezifität gibt an, mit welcher Wahrscheinlichkeit ein unauffälliges Testergebnis in einer homogenen Gruppe Gesunder gefunden wird.
Die Angaben der Hersteller liegen hier für das IgG i.d.R. über 98 %, zum Teil sogar bei nahezu 100 %. Das würde bedeuten, dass jeder IgG-Positive tatsächlich bereits infiziert war, und es somit nahezu keine falsch positiven Ergebnisse gibt. Das entspricht aber leider nicht der Realität, denn bei Angabe der (analytischen) Spezifität wird der Einfluss der Verteilung von Kranken und Gesunden in der untersuchten Gruppe oft nicht berücksichtigt (Vortest-Wahrscheinlichkeit).
Untersuchung
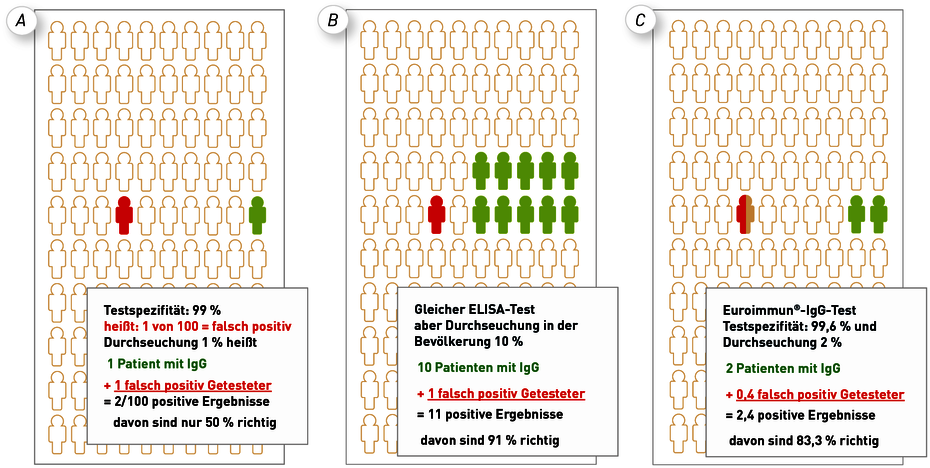
Abb. 4 A Bei einem ELISA-Testkit mit einer analytischen Spezifität von 99 % ist einer von 100 Getesteten falsch-positiv (rot). Bei einer angenommenen Durchseuchung in der Bevölkerung von 1 % wäre IgG statistisch bei einem zweiten von den 100 Untersuchten richtig-positiv (grün). Das bedeutet, dass von 2 IgG-positiv getesteten Patienten ein Patient (50 %) falsch positiv wäre. In der Abb. 4B ist dargestellt, dass mit dem gleichen Test der positive Vorhersagewert schon auf 91 % steigt, wenn eine Population mit einer 10 %igen Durchseuchung untersucht würde. Die Abb. 4C widerspiegelt die geschätzte Realität mit dem ELISA-Testkit der Fa. Euroimmun wieder (Spezifität mit 99,6 %) und der Annahme einer Durchseuchung von 2 % in einer Region. Der prädiktive Wert läge hier bei 83,3 %, d.h. dass fast 2 von 10 Untersuchten ein falsch-positives IgG hätten.
Solange eine Erkrankung in der Bevölkerung selten ist (und das ist bei SARS-CoV-2 aktuell noch der Fall), gibt der sogenannte positive prädiktive Wert die Realität besser wieder (siehe Abb. 4). So lässt sich dieser z. B. bei einer angenommenen Durchseuchung von 2 % und einer analytischen Testspezifität von 99,6 % (Daten für IgG EUROIMMUN) mit 83,3 % berechnen. Das bedeutet, dass von 10 IgG-positiv getesteten Patienten statistisch nur 8,3 tatsächlich positiv sind. Das ist aber unumgänglich und durchaus akzeptabel, wenn es in der Praxis berücksichtigt wird. Generell kann keine serologische Untersuchung bzw. Laboruntersuchung 100 % spezifisch und sensitiv sein. Sie kann einen Verdacht immer nur erhärten oder entkräften (siehe auch Box 1).
|
Box 1 Begriffsdefinitionen
Ein positives IgG sollte bestätigt werden
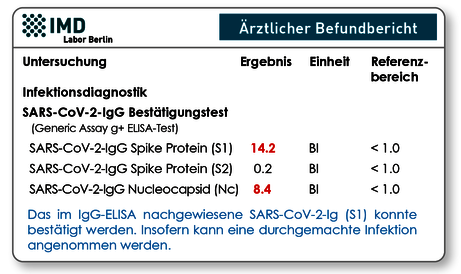
Es ist in der Infektionsserologie gebräuchlich, dass positive Screeningtests durch z.B. Immunoblots oder andere spezifischere Tests bestätigt werden müssen. Auch für den Nachweis der SARS-CoV-2-IgG-Antikörper gibt es diese Möglichkeit. Bei diesem Test wird das „Antikörperprofil“ bestimmt, d.h. es werden IgG-Antikörper gegen die S1- und S2-SpikeProteine und das Nukleokapsid-Protein parallel aus einer Serumprobe analysiert. Anhand der Anzahl positiver Ergebnisse und der erreichten cut off-Werte, kann ein positives IgG im Screeningtest mit deutlich größerer Sicherheit als richtig positiv oder falsch positiv identifiziert werden.
Abb. 5. Befundbeispiel des IgG-Bestätigungstest. Das im Screeningtest positive IgG (S1) wurde bestätigt, denn es liegen signifikant hohe IgGs gegen S1-Protein und Nucleocapsid vor.
Kann man sich auf IgM und IgA verlassen?
Vor allem IgM, aber auch IgA zeigen auf Grund ihrer polymeren Struktur (mehrere Bindungsarme, siehe Abb. 4) eine höhere Avidität. Das bedeutet, dass sie „klebriger“ sind, eine Eigenschaft, die in der Frühphase einer Infektion hilft, die noch fehlende Passgenauigkeit auf das Virus auszugleichen. Der Nachteil dieser biologisch sinnvollen Eigenheit ist, dass sie auch in den Labortests „klebriger“ sind und deshalb häufiger falsch positive Ergebnisse bewirken, v. a. im Vergleich zum IgG.
Nach der aktuellen Datenlage muss herstellerübergreifend in etwa 12-14 % der Fälle mit falsch positiven Ergebnissen gerechnet werden. Deshalb sollte die Diagnose Covid-19 nie nur an Hand positiver IgA- oder IgM-Antikörper gestellt werden. Für die Diagnosestellung sollte man immer den PCRDirektnachweis anstreben. Ab der 2. Woche, wenn dessen Sensitivität abfällt, muss die Diagnose klinisch oder durch ein CT der Lunge gestützt werden. Eine Kontrolluntersuchung im Abstand von 14 Tagen bringt im Normalfall Klarheit, da es im Falle einer tatsächlichen Infektion dann zu einer Bildung von IgG (Serokonversion) kommt.
Abb. 6 Struktur und Funktion der Antikörperklassen
Verzögerte oder fehlende Antikörperbildung bei fehlender und milder Symptomatik
In den meisten Studien wurden Patienten mit schweren Verläufen untersucht. Milde oder symptomlose Verläufe zeigen i.d.R. eine verzögerte Antikörperbildung, sowie auch niedrigere Titer in allen drei Antikörperklassen. Das sollte in der Praxis nicht nur bei der Abklärung des akuten Infektionsverdachtes beachtet werden, sondern auch, wenn man eine abgelaufene Infektion nachweisen will (To Kk, Lancet Infect Dis. 2020; Zhao et al; Clin Infect Dis. 2020 Mar 28).
Persistierende IgA- und IgM-Nachweise sind möglich
Es ist auch von anderen Viren und Bakterien bekannt, dass bei einigen Patienten sowohl IgA- als auch IgM-Antikörper über viele Wochen persistieren können. In einer chinesischen Studie an SARS-CoV-2-Infizierten war IgM nach 7 Wochen sogar noch bei 33 % der Patienten positiv. Dieses könnte durch unspezifische Reaktivität dieser beiden Antikörperklassen bedingt sein (siehe unten) oder auch auf tatsächlicher Persistenz beruhen. Sobald auch IgG positiv ist, ist die IgM-Persistenz mit hoher Wahrscheinlichkeit nicht mehr als Indiz einer persistierenden Infektiosität anzusehen. Man geht bisher davon aus, dass mit der Bildung von IgG (d.h. erfolgter Serokonversion) die Infektiosität beendet ist.
Antikörper können gegen unterschiedliche Virusbestandteile gerichtet sein
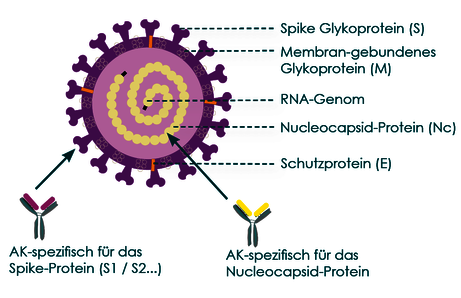
Abb. 7 Darstellung möglicher SARS-CoV-2-Antikörper-Bindungstellen
Der Nachweis von Antikörpern im Patientenserum erfolgt mit sog. Enzymimmunoassays, i.d.R. ELISA-Tests. Als SARSCoV-2-spezifische Bindungsproteine werden dabei je nach Hersteller unterschiedliche Bestandteile des Virus eingesetzt, was zum Teil auch unterschiedliche Ergebnisse erklären kann. In den gängigen SARS-CoV-2-Antikörpertests wird entweder das Spike-Protein (S1-Domäne) oder das NucleocapsidProtein (Nc-Protein) als spezifisches Zielantigen verwendet. Abb. 6 zeigt, dass das Nucleocapsid-Protein ein Eiweiß ist, welches innerhalb des Virus liegt und dort das RNAGenom des Virus umgibt. S1-Proteine sind Eiweiße auf der Virusoberfläche. Es handelt sich um die Proteine, mit denen das Virus an den ACE2-Rezeptor menschlicher Zielzellen bindet, um in diese einzudringen.
Bei Patienten mit fehlender Antikörperbildung in einem verwendeten Test trotz dringendem klinischen oder anamnestischen Verdacht, könnte eine Kontrolle mit einem ELISA sinnvoll sein, der das jeweilige andere Protein als Zielantigen enthält. Aus diesem Grund haben wir uns in unserem Labor für einen Testkit mit S1-Zielantigen (EUROIMMUN) und einen mit Nc-Protein (Abbott) entschieden, so dass wir fragliche Ergebnisse auch komplikationslos laborintern abklären können.
Bedeutet Antikörpernachweis auch Immunität?
Das ist nicht sicher, denn es kann wegen der Kürze der Existenz des Virus noch nicht durch Fallkontrollstudien belegt sein. Versuche an Rhesusaffen deuten zumindest eine zeitweise Immunität (Infektionsschutz) an nach primärer Infektion (Bao, L. et al. Preprint at bioRxiv). Weiterhin konnte im Rahmen der Forschung gezeigt werden, dass es eine Korrelation zwischen dem Titer neutralisierender Antikörper im Virusneutralisationstest und dem Serum-Antikörpertiter sowohl gegen S1-Protein als auch Nucleocapsid-Protein (Nc) gibt. Wichtig ist, dass anhand eines positiven SARSCoV-2-IgG-Befundes zwar eine stattgefundene Infektion anzunehmen ist, dies allerdings nicht zwangsweise bedeutet, dass damit ein Infektionsschutz (Immunität) verbunden ist. Die für diese Aussage notwendigen Langzeitstudien kann es aktuell noch nicht geben.
Immunität auch ohne Antikörperbildung möglich
In unserem eigenen Patientenkollektiv, aber auch in verschiedenen Studien wurde beobachtet, dass es in ca. 3 % der Fälle vorkommt, dass Patienten mit PCR-gesicherter Infektion auch nach Wochen keine Antikörper bilden. Ursache können Immundefekte sein oder auch eine atypisch verzögerte Antikörperbildung. Bei sicher durchgemachter Infektion kann trotzdem Immunität bestehen, da die Antikörper zwar zur Immunabwehr des Virus beitragen (z. B. durch Neutralisation, d.h. Hemmung der Aufnahme in Zielzellen), aber die Immunabwehr gegen das Virus vorrangig durch die T-Lymphozyten getragen wird. So ist zu erklären, dass eine komplette Elimination des Virus in vielen Fällen stattfindet, ehe Antikörper im Blut des Patienten nachweisbar sind. Entsprechende zelluläre Tests werden aktuell im Rahmen der Forschung angewandt, sind aber für die Laborroutine noch nicht verfügbar. Aktuell wird auch angenommen, dass die spezifische (auf Kreuzreaktivität beruhende) T-Zell-Immunität dafür verantwortlich ist, dass Kinder und einige Erwachsene die Infektion ohne Symptome einer Primärinfektion überstehen. Sicher ist, dass diese „Immunität“ nicht auf Antikörpern beruht.
Material und Kosten der Antikörpertestung
Die Bestimmung der SARS-CoV-2-Antikörper sowie der IgG-Bestätigungstest benötigen jeweils 2 ml Serum. Empfehlenswert ist indikationsunabhängig die Bestimmung der IgG- und IgA-Antikörper sowie bei V.a. frische (akute) Infektion zusätzlich auch IgM. Sofern der Bestätigungstest bei positivem oder grenzwertigem IgG laborintern nachgezogen werden soll, vermerken Sie dieses bitte auf dem Anforderungsschein. Die Kosten für Selbstzahler entnehmen Sie bitte dem Anforderungsschein. Die Privatkassen übernehmen nach unserem Wissen die Kosten.
Abrechnung auf Kosten der Gesetzlichen Krankenversicherung (Stand 15.5.2020)
Die KBV hat am 7. Mai die Abrechenbarkeit für GKV-Versicherte klargestellt (www.kbv.de). An der Ausgestaltung einer eigenen EBM-Ziffer wird im Bewertungsausschuss aktuell noch gearbeitet. Bis dahin ist der Antikörpernachweis nach GOP 32641 EBM nur indiziert, wenn eine aktuelle Covid19typische respiratorische Symptomatik besteht. Der anfordernde Arzt dokumentiert dies durch die Ziffer 88240 auf dem Überweisungsschein. Keine Leistungen der GKV sind Antikörperbestimmungen zum Nachweis evtl. bestehender Immunität, d.h. ohne aktuell vorhandenen Infektionsverdacht. Insofern ist auch der für diese Testindikation entscheidende IgG-Bestätigungstest keine GKV-Kassenleistung, sondern Selbstzahlerleistung, ebenso wie alle Untersuchungen auf Wunsch/Verlangen des Patienten, Arbeitgebers, von Behörden, Bildungsträgern, Reiseunternehmen etc.
Literatur
- Guo Li et al. Profiling Early Humoral Response to Diagnose Novel Corona- virus Disease (COVID-19). Clin Infect Dis. 2020Zhao J, Clin Infect Dis. 2020
- Xiao AT, Gao C, Zhang S. Profile of specific antibodies to SARS-CoV-2: The first report. J Infect. 2020
- Padoan A et al. Analytical performances of a chemiluminescence immuno assay for SARS-CoV-2 IgM/IgG and antibody kinetics Clin Chem Lab Med.2020
- Xie J. et al. Characteristics of patients with coronavirus disease (COVID-19) confirmed using an IgM-IgG antibody test. J Med Virol. 2020
- Sun B, Feng Y, Mo X. Kinetics of SARS-CoV-2 specific IgM and IgG responses in COVID-19 patients.Emerg Microbes Infect. 2020
- Jääskeläinen AJ et al. Evaluation of commercial and automated SARS- CoV-2 IgG and IgA ELISAs using coronavirus disease (COVID-19) patient samples. Euro Surveill 2020
- Okba N et al. Severe Acute Respiratory Syndrome Coronavirus 2-Specific Anti body Responses in Coronavirus Disease 2019 Patients. Emerg Infect Dis. 2020
- To Kk et al. Temporal Profiles of Viral Load in Posterior Oropharyngeal Saliva Samples and Serum Antibody Responses During Infection by SARS-CoV-2: An Observational Cohort Study, Lancet Infect Dis. 2020