Stoffwechselgenetik des Vitamin D
Bildung von aktivem Vitamin D
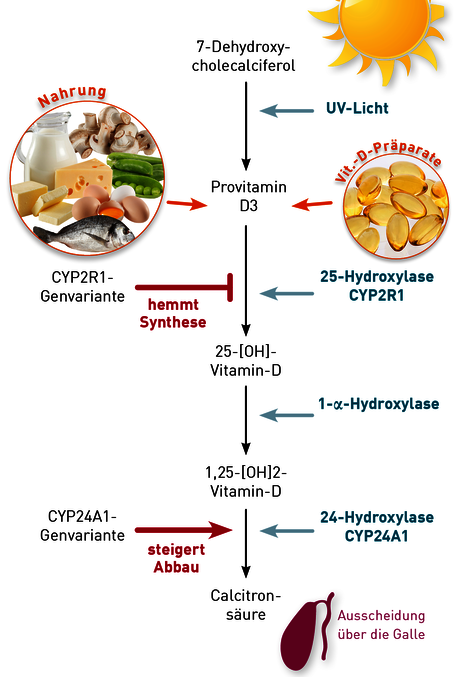
Aus dem im menschlichen Organismus in ausreichender Menge vorhandenen 7-Dehydrocholesterol wird in der Haut durch Photoisomerisierung bei UVB-Exposition zunächst Prävitamin D3 (Cholecalciferol) gebildet. In der Leber wird Prävitamin D3 durch die 25-Hydroxylase (CYP2R1) zu 25-(OH)-Vitamin-D metabolisiert. Dieses wird zu etwa 99 % an Proteine gebunden und als Vitamin-D-Speicher in die Blutzirkulation abgegeben. Ein Teil des 25-(OH)-Vitamin-D wird vor allem in den proximalen Tubuluszellen der Niere, aber für den „Eigenbedarf“ auch in vielen anderen Körperzellen, durch das Enzym 1-alpha-Hydroxylase zum aktiveren Metaboliten 1,25-(OH)2-Vitamin-D umgewandelt.
Abb.1 Auf- und Abbau des Vitamin D und dabei beteiligte Enzyme. Genetische Varianten in den Enzymen CYP2R1 und CYP24A1 beeinflussen diesen VitaminD-Stoffwechsel nachweislich.
Zelluläre Wirkmechanismen des Vitamin D
In den Körper- und Immunzellen wirken sowohl 1,25-(OH)2- Vitamin-D als auch 25-(OH)-Vitamin-D wie Steroidhormone. Anders als häufig angenommen, ist auch 25-(OH)-Vitamin-D wirksam. Die Rezeptoraffinität von 25-(OH)-Vitamin-D ist zwar 100-500fach niedriger, dafür ist die Blutkonzentration aber ca. 1000fach höher als die des 1,25-(OH)2-Vitamin-D. Die freien Vitamin D-Moleküle passieren die Zellmembran und binden an den nukleären, also im Zellkern befindlichen Vitamin-D-Rezeptor (VDR). Dieser bindet als Transkriptionsfaktor im Komplex mit Vitamin D an die Promotorregion hormonsensibler Gene und induziert deren Proteinsynthese.
Abbau von Vitamin D
Der Abbau von 1,25-(OH)2-Vitamin-D und in geringerem Maße auch 25-(OH)-Vitamin-D erfolgt durch einen mehrstufigen Prozess, der mit der 24-Hydroxylierung (CYP24A1) beginnt und in der Produktion von wasserlöslicher Calcitriolsäure endet. Das passiert hauptsächlich in Leber und Nieren, in geringerem Maße aber auch in vielen anderen Zellen wie z.B. den Makrophagen. Die Calcitronsäure wird über die Galle ausgeschieden.
Genetische Varianten beeinflussen den Vitamin-DStoffwechsel und darüber den Therapieerfolg
Der Stoffwechsel des Vitamin D wird neben metabolischen Rückkopplungsmechanismen auch durch die genetische Ausstattung (Pharmakogenetik) beeinflusst. Studien an kaukasischen Probanden identifizierten genetische Varianten (Polymorphismen) im CYP2R1- und CYP24A1-Gen, die messbar das Ansprechen einer Vitamin-D-Therapie modifizieren.
Verminderte 25-(OH)-Vitamin-D-Bildung durch 25-Hydroxylase (CYP2R1)-Genvariante
Das Enzym CYP2R1 katalysiert die Umwandlung von Vitamin D zu 25-(OH)-Vitamin-D in der Leber (Abb. 2). Ein Polymorphismus mit der rs-Nummer 10766197 führt zum Basenaustausch G → A. Diese genetische Variante geht mit einer reduzierten Enzymaktivität einher. Infolgedessen ist die „Gewinnung“ von 25-(OH)-Vitamin-D aus dem endogenen, aber auch aus therapeutisch verabreichtem Provitamin D3 geringer als bei Patienten ohne diesen Polymorphismus. Das ist in der Praxis häufig daran erkennbar, dass die Blutspiegel von 25-(OH)-Vitamin-D und auch freiem Vitamin D unter Therapie langsamer ansteigen bzw. auf niedrigerem Niveau verharren. Die Prävalenz dieses Polymorphismus in der kaukasischen Bevölkerung beträgt etwa 4 % homozygot und ca. 30 % heterozygot.
Verstärkter Vitamin-D-Abbau durch 24-Hydroxylase (CYP24A1)-Genvariante
Das Enzym CYP24A1 katalysiert den Abbau von 1,25-(OH)2- Vitamin-D, aber auch 25-(OH)-Vitamin-D und zu inaktiven Metaboliten (Abb. 2). Der Polymorphismus rs6013897 mit dem Basenaustausch T → A führt zu einer gesteigerten Enzymaktivität dieses Enzyms und somit zu einem beschleunigten Abbau von aktivem Vitamin D. Das betrifft sowohl den 25-(OH)-Vitamin-D-, als auch den 1,25-(OH)2-Vitamin-D-Abbau. Demzufolge führt auch diese genetische Variante oft dazu, dass es unter Vitamin-D-Therapie nicht zu einem erwarteten adäquaten Anstieg des Serum-25-(OH)-Vitamin-D oder des freien Vitamin-D-Spiegels kommt. Ca. 12-21 % der kaukasischen Bevölkerung tragen diesen Polymorphismus heterozygot, etwa 1-2 % homozygot.
Abb 2. Befund einer Patientin, bei der es trotz intensiver Vitamin D-Substitution nur zu einem geringgradigen Anstieg des freien Vitamin D im Blut gekommen ist. Die genetische Untersuchung ergab das Vorliegen der CYP2R1- und CYP24A1-Polymorphismen als mögliche Ursache des Therapieversagens.
Indikationen für die Bestimmung der Vitamin-D-Stoffwechselgenetik (CYP2R1 / CYP24A1
- persistierend niedrige Vitamin-D-Spiegel trotz adäquater Substitution
- Anstieg des 1,25-(OH)2-Vitamin-D / 25-(OH)-Vitamin-D-Quotienten (Vitamin-D-Status) unter Therapie
Material
2 ml EDTA-Blut
Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen. Für genetische Untersuchungen benötigen wir die Einverständniserklärung des Patienten. Das Blutentnahme- und Versandmaterial wird vom Labor kostenfrei zur Verfügung gestellt.
Abrechnung
Pharmakogenetische Untersuchungen sind, bis auf wenige Ausnahmen, keine gesetzliche Kassenleistung.
Im privatärztlichen Bereich ist eine Abrechnung gegeben.
Die Kosten für Selbstzahler entnehmen Sie bitte dem PDF-Dokument.
Literatur
- Barry EL et al. Genetic variants in CYP2R1, CYP24A1, and VDR modify the efficacy of vitamin D3 supplementation for increasing serum 25-hydroxyvitamin D levels in a randomized controlled trial J Clin Endocrinol Metab 2014 ;99):2133-7.