Allergien und Unverträglichkeiten
Lymphozytentransformationstest (LTT)
Metalle, Acrylate (Kunststoffe) aber auch zahlreiche weitere, zum Beispiel in Wurzelfüllmaterialien oder Zementen enthaltene, Bestandteile können potentielle Allergene sein.
Sensibilisierungen auf zahnärztliche Werkstoffe beruhen bis auf wenige Ausnahmen auf Typ-IV-Sensibilisierungen (Allergien vom Spättyp). Metalle und Acrylate können körpereigene Eiweiße verändern und diese dadurch zum Allergen machen. Bei einer Typ-IV Sensibilisierung bilden sich spezifische T-Lymphozyten, die das Allergen bzw. allergenveränderte körpereigene Proteine (Hapteneffekt) als fremd erkennen. Bei sensibilisierten Patienten reagiert das Immunsystem nach Kontakt mit dem entsprechenden Allergen mit einer Immunaktivierung. Diese kann sich in einer Lokalsymptomatik äußern, aber auch systemische Entzündungsreaktionen verursachen oder verstärken.
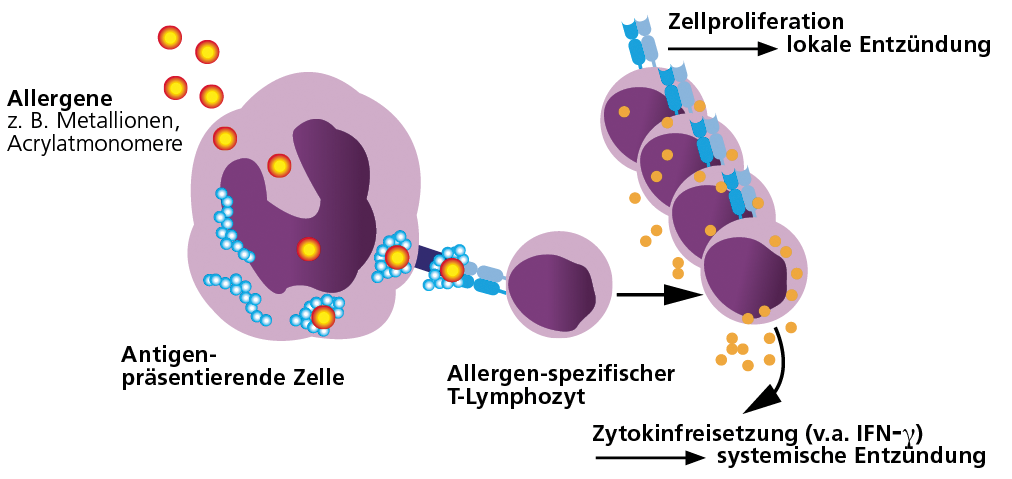
Abb. Metalle, Acrylatmonomere und viele andere in der Zahnmedizin relevanten Materialbestandteile sind Haptene. Diese entfalten ihre Allergenität erst durch Bindung und Modifikation zelleigener Proteine.
Wann muss man an eine allergisch bedingte Zahnmaterialunverträglichkeit denken?
Als lokale Zeichen können Stomatitiden, Lichen ruber planus, Gingivitis oder Parodontitis auftreten. Sie sind allerdings nicht obligat, da die oralen Schleimhäute immunologisch wenig reaktiv sind. Auf Grund der immunologischen Besonderheiten der Mundschleimhaut kommt es daher vor, dass Lokalsymptome wie Zungenbrennen oder Kiefer- und Zahnschmerzen nicht mit einem morphologischen Korrelat einhergehen.
Da Immunreaktionen prinzipiell systemischen Charakter tragen, können bei Typ IV-Allergien zahlreiche Allgemeinsymptome auftreten oder verstärkt werden. Zu diesen unspezifischen Entzündungssymptomen zählen: Abgeschlagenheit, Schlafstörungen, depressive Verstimmungen, Muskelschmerzen, Arthralgien (Fibromyalgie), Parästhesien, Kopfschmerzen, Migräne oder auch Neuralgien.
Zudem ist bekannt, dass bei sensibilisierten Patienten eine dauerhafte Exposition mit Metallionen (u.a. Quecksilber, Gold, Nickel) Autoimmunität auslösen kann.
Mit dem LTT lassen sich allergenspezifische T-Lymphozyten nachweisen.
Der LTT ist eine Labormethode zum Nachweis einer spezifischen zellulären Sensibilisierung. Der Test basiert auf dem Prinzip der Allergen spezifisch induzierten Zellteilung von Lymphozyten nach Kontakt mit ihrem „passenden“ Allergen. Eine positive Reaktion im LTT beweist die Existenz von Allergen-spezifischen Lymphozyten (Gedächtniszellen) im Blut des Patienten.
Es gibt zwei Fragestellungen, die mit dem LTT beantwortet werden:
- Ist ein Ersatz des vorhandenen Zahnersatzmaterials notwendig?
Mit dem LTT kann ein Zusammenhang zum Material nachgewiesen bzw. ausgeschlossen werden, wenn nach dem Einbringen von Zahnersatzmaterial Beschwerden auftreten (kurative Fragestellung). - Welche Materialien können verwendet bzw. nicht verwendet werden?
Mit dem LTT können vor dem Einbringen neuer Zahnersatzmaterialien bestehende Sensibilisierungen auf alle enthaltenen Bestandteile ausgeschlossen werden (präventive Fragestellung).
Auf welche Materialien kann im LTT getestet werden?
Prinzipiell kann im LTT auf nahezu alle Zahnersatzmaterialien getestet werden, sofern im Labor ein zytotoxischer Effekt oder unspezifisch aktivierende Faktoren ausgeschlossen werden.
Für häufig wiederkehrende Fragestellungen wurden die nachfolgenden Profile entwickelt, in denen die bekannten sensibilisierenden Einzelallergene standardisiert untersucht werden.
| LTT-Metalle | Gold, Nickel, Palladium, Chrom, Kobalt, Molybdän, Aluminium, Platin, Cadmium, Quecksilber, Kupfer, Silber, Zinn, Ethylquecksilber |
| LTT-Kunststoffe | Methylmethacrylat (MMA/PMMA), TEGDMA, BISGMA, BISDMA, HEMA, Diurethandimethacrylat, Ethylenglycoldimethacrylat, Buthandiol-1-4-methacrylat, N,N-Dimethyl-4-toluidin, Benzoylperoxid, Hydrochinon, Campherchinon, Phthalate, Formaldehyd |
| LTT-Kombi-Profil (Dentalcheck) | Gold, Nickel, Palladium, Chrom, Kobalt, Platin, Quecksilber, Kupfer, Silber, Zinn, Methylmethacrylat (MMA/PMMA), HEMA, TEGDMA, BISGMA |
| LTT-Goldlegierungen | Gold, Silber, Platin, Kupfer, Palladium, Zinn, Gallium, Indium, Iridium, Rhodium, Tantal, Ruthenium |
| LTT-Amalgam | Amalgambestandteile und organische Quecksilberverbindungen: Quecksilber, Kupfer, Silber, Zinn (Amalgam), Ethylquecksilber, Phenylquecksilber, Methylquecksilber |
| LTT-Wurzelfüllmaterialien | Rohguttapercha, Perubalsam, Eugenol, Polydimethylsiloxan, Silikonöl, Bismutoxid, Silber, Terpentinöl, Kolophonium, Triethanolamin, Erdnussöl, Paraformaldehyd, Bisphenol A, Epichlorhydrin |
| LTT-Keramik + Zemente | Vanadium, Aluminium, Titan, Kobalt, Chrom, Barium, Silicium, Cer, Bor, Mangan, Antimon, Phosphatzement (Harvard), Glasionomerzement (Ketac-Bond) |
| LTT-Nativmaterial | Untersuchung auf selektiv ausgewählte Materialien, die auch mit ins Labor geschickt werden können. |
Zur ausführlichen Diagnostik der Titanunverträglichkeit verweisen wir auf das Kapitel Titanunverträglichkeit.
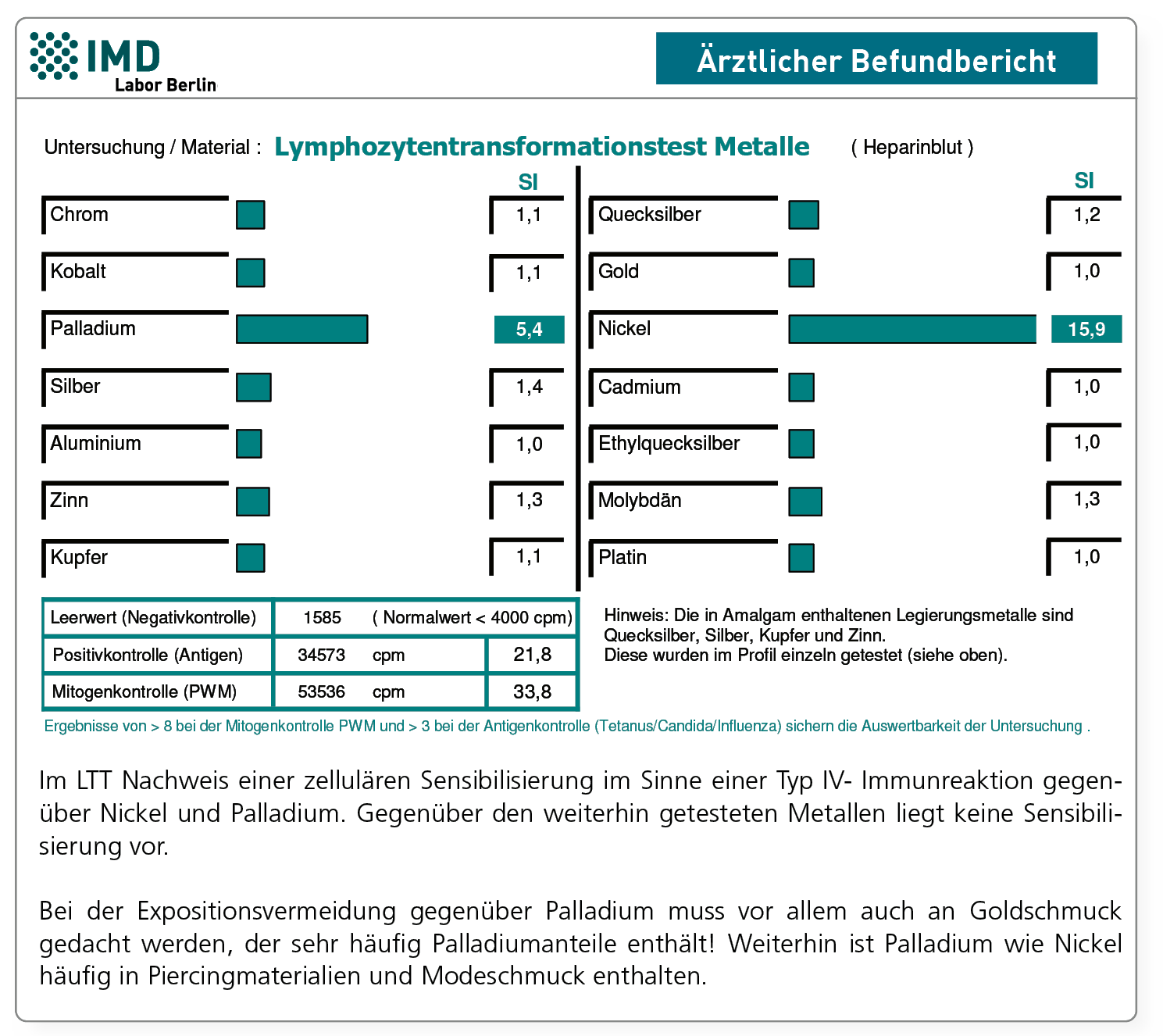
Hinweis zum Befund:
Die Ursache lag hier nicht im zahnärztlichen Bereich, sondern konnte in einem Pd/Ni-Piercingmaterial identifiziert werden.

Hinweis zum Befund: Der Befund einer Patientin zeigt die seltene Konstellation einer Ko-Sensibilisierung auf Methylmethacrylat, TEGDMA und HEMA. Die Methylmethacrylat-Sensibilisierung war aufgrund einer allergischen Kontaktdermatitis auf Acrylat-haltige künstliche Fingernägel vermutet worden. Hier sollten zukünftig nicht nur die künstlichen Fingernägel sondern auch z. B. Medikamente mit Acrylatkapseln vermieden werden. Bei Prothesenkunststoffen oder Schienenmaterial muss gewährleistet sein, dass keine MMA-Freisetzung erfolgt. Auf Grund der bestehenden Sensibilisierung auf TEGDMA und HEMA kommen nur TEGDMA- und HEMA-freie Füllungskunststoffe oder Kleber in Betracht, z. B. ELS-Kunststoff der Firma Saremco, Schweiz. Dieser Kunststoff enthält BISGMA auf welches hier aktuell keine Allergie besteht.
Die hier vorliegende Konstellation einer Mehrfachsensibilisierung ist sehr selten. In ca. 80 % der Fälle besteht die Sensibilisierung nur auf Methylmethacrylat (MMA). Ein Kontakt zu MMA ist bereits im Kindesalter über Klebstoffe oder Pflaster gegeben. Sensibilisierungen auf Dimethacrylate sind seltener, trotzdem aber für 20 % der positiven LTT-Analysen verantwortlich. Allerdings haben sie weitreichendere Konsequenzen, da Sensibilisierungen auf Dimethacrylate auch bei Kunststofffüllungen oder Klebern berücksichtigt werden müssen.
Insbesondere für präventive Testungen wurde ein Kombinationsprofil (Dentalcheck) mit den wichtigsten Metallen und Acrylaten entwickelt, welches folgende Problembereiche abdeckt:
- Goldlegierungen (Gold, Silber, Palladium, Platin, Kupfer und Zinn)
- NEM-Legierungen (Chrom, Kobalt, Nickel)
- Amalgam (Quecksilber, Silber, Kupfer, Zinn)
- Prothesenkunststoffe (MMA/PMMA)
- Acrylathaltige Komposite und Zemente (HEMA, TEGDMA, BISGMA)

Hinweis zum Befund:
Die Untersuchung erfolgte aufgrund des Verdachtes auf Amalgamunverträglichkeit. Diese hat sich durch den positiven LTT auf anorganisches Quecksilber bestätigt. Die deutliche Sensibilisierung auf Gold war ein Zufallsbefund. Erst im Nachhinein gab die Patientin auf Befragen an, dass sie Goldschmuck prinzipiell nicht mehr trägt, da sich in früheren Jahren Entzündungszeichen z. B. an den Ohrläppchen gezeigt hatten. Der Befund war insofern wichtig, weil der Ersatz der Amalgamfüllungen durch Goldlegierungen somit streng kontraindiziert war.
Die Sensibilisierung auf Methylmethacrylat hatte keine unmittelbaren aktuellen zahnmedizinischen Konsequenzen. Der Patientin wurde jedoch geraten, künstliche Fingernägel streng zu meiden (auch wegen der Gefahr der Inhalation von MMA in den Nagelstudios) sowie Retardmedikamente (MMA-Kapsel) und Acrylatfarben. Es wurde ein Allergiepass ausgestellt.
Ja, wenn die Materialien zusammen mit der Blutprobe ins Labor eingesendet werden. Bewährt hat sich dieses Verfahren insbesondere bei komplexen Materialien, wie z.B. Zementen, Kompositen, Prothesenmaterialien, Knochenersatzmaterialien, Wurzelfüllmaterialien
(auch Stifte) sowie intraoral gewonnenen Metall- und Kunststoffspänen.
Bei negativ getesteten Materialien ist ausgeschlossen, dass gegenüber darin enthaltenen (deklarierten oder nicht deklarierten) Bestandteilen eine Sensibilisierung vorliegt. Im LTT positiv getestete Materialien dürfen dagegen keinesfalls eingebracht werden, da auf mindestens ein enthaltenes Allergen eine Typ IV-Sensibilisierung besteht.
Hinweis: Gängige in der Zahnmedizin verwendete Nativmaterialien sind im Labor vorrätig. Bitte rufen Sie uns unter +49 30 77001-220 an und lassen sich diese Liste per Fax zusenden.

Hinweis zum Befund:
Getestet wurde auf vier mit eingesendete Substanzen bzw. Materialien. Der Befund zeigt eine Sensibilisierung auf ein Wurzelfüllmaterial. Die Nachtestung konnte beweisen, dass dieser Befund auf einer Sensibilisierung gegenüber Eugenol beruht. (Nachtestung hier nicht dargestellt).
Hinweis: Um die Produktneutralität zu wahren, wurde der Name des Präparates geschwärzt.
Auf Guttapercha, aber auch auf die in Sealern enthaltenen Bestandteile, können allergische Sensibilisierungen vorliegen. Die bekannten Allergene sind im Profil LTT-Wurzelfüllmaterial enthalten.

Hinweis zum Befund:
Befund eines Patienten bei dem Jahre nach Wurzelbehandlungen apikale Entzündungen an mehreren Zähnen auftraten. Außerdem bestand der Verdacht auf eine allergisch induzierte Kontaktdermatitis, deren Beginn zeitlich mit der Wurzelbehandlung in Einklang zu bringen war. Die damals verwendeten Sealer konnten nicht mehr ermittelt werden, weshalb hier das Profil LTT-Wurzelfüllmaterialien gewählt wurde in dem gängige Inhaltsstoffe untersucht werden. Wenn die Materialien bekannt gewesen wären, hätte man die Untersuchung des unmittelbar verwendeten Nativmaterials gewählt. Aus der Anamnese war bei dem Patienten eine allergische Pflasterunverträglichkeit bekannt, was sehr wahrscheinlich darauf beruht, dass (braunes) Pflaster Kolophonium enthält (wobei prinzipiell auch an Methylmethacrylat zu denken wäre).
Als Konsequenz des Befundes wurden die Zähne je nach klinischem und radiologischem Befund zum Teil entfernt bzw. die Wurzelfüllung revidiert. Die verwendeten Materialien (frei von Eugenol und Kolophonium) wurden als Nativmaterial vorher untersucht. Wegen der Sensibilisierung auf Rohguttapercha wurde ein (ebenfalls vorgetestetes) synthetisches Guttapercha verwendet.
Es gilt zu beachten, dass bei der Allergietestung auf Guttapercha ausschließlich natürliches Rohguttapercha verwendet wird. Da z. B. synthetisch hergestelltes Guttapercha oder verarbeitete natürliche Rohstoffe nicht mehr alle Allergenkomponenten des Rohguttaperchas
enthalten müssen, kann es sinnvoll sein, vor allem bei präventiven Fragestellungen, das spezifisch zur Verwendung anstehende Guttaperchapräparat (auch Stifte) im LTT als Nativmaterial zu testen.
Um die Bedeutung der im LTT-Profil enthaltenen Bestandteile darzustellen, sind nachfolgend die (bekannten) wichtigen Bestandteile häufig verwendeter temporärer oder permanenter Wurzelfüllmaterialien angegeben.
Die Inhaltsstoffe wurden den Sicherheitsdatenblättern oder den Produktinformationen entnommen. Für die Richtigkeit und die Vollständigkeit kann unsererseits keine Gewähr übernommen werden.
| N2 Endodontic Cement® | enthält u.a. Paraformaldehyd, Titanoxid, Zinkoxid (Pulver) und Eugenol, Rosenöl, Lavendelöl, Erdnussöl (Flüssigkeit) |
| Endomethasone® | enthält u.a. Thymoljodid, Zinkoxid, Hydrocortisonazetat (Pulver) und Eugenol (Flüssigkeit) |
| AH Plus® | Bisphenol A Diglycidylether, Bis-[4-(-2,3epoxypropoxy)phenyl]methane, PDMS |
| AH26® | enthält u.a. Bismutoxid, Methenamin, Titanoxid, Silber |
| Aptal-Harz Wurzelfüllung® | enthält u.a. Zinkoxid, Kolophonium (Pulver), Eugenol, Perubalsam, Terpentinöl (Flüssigkeit) |
| Rocanal Permanent Vital R2® | enthält u.a. Anisöl, Phenylphenol (Pulver), Eugenol, Kolophonium, Rizinusöl (Flüssigkeit) |
| Hermetic® | enthält u.a. Zinkoxid, Zinkstearat, Zirkonium(IV)oxid (Pulver), Eugenol, Perubalsam (Flüssigkeit) |
| Super EBA® | enthält u.a. Eugenol (Flüssigkeit), Zinkoxid, Aluminiumoxid (Pulver) |
| Apexit Plus® | enthält u.a. Calciumhydroxid, Calciumoxid, Kolophonium |
| Guttapercha-Stifte | können je nach Anbieter enthalten Zinkoxid, gereinigte Guttapercha, Kolophonium (1 - 4,1%), Schwermetalle 1,5 - 30 %, evtl. Pigmente, Lebensmittelfarbstoffe |
Ein positives Resultat im LTT sagt aus, dass gegenüber dem betreffenden Allergen eine Sensibilisierung vom Typ IV besteht. Zukünftig darf kein Material verwendet werden, welches dieses Allergen enthält (präventive Aussage). Im Falle einer kurativen Fragestellung sollte beachtet werden, dass mit keinem Allergietest (auch nicht mit dem Epikutantest) der unmittelbare kausale Zusammenhang zur bestehenden Beschwerdesymptomatik zu beweisen ist.
Andere Quellen beachten!
Daher muss bei einer nachgewiesenen Sensibilisierung sorgfältig abgewogen werden, ob das jeweilige Problemmaterial entfernt und ersetzt werden sollte. Entscheidend ist dabei die klinische Symptomatik, keinesfalls ein positives Testergebnis allein. Andere Expositionsquellen sind primär oder gleichzeitig zu eliminieren (ausführliche Informationen zu anderen Expositionsquellen erhalten Sie mit jedem LTT-Befund).
Worin sind allergene Schwermetalle und Kunststoffe enthalten?
Was wird für den LTT benötigt?
Für jedes Untersuchungsprofil werden 20 ml Heparin- und 5 ml Vollblut zur Serumgewinnung benötigt.
Das Abnahme- und Versandmaterial wird vom Labor kostenfrei zur Verfügung gestellt. Die Blutentnahmesets sind von allen gängigen Herstellern verfügbar.
Bitte kontaktieren Sie unsere Mitarbeiter der regionalen Praxisbetreuung oder unser Servicepersonal im Labor (Tel. +49 30 77001-220), welche alle organisatorischen Fragen gerne für Sie beantworten.
Wie erfolgt die Blutentnahme?
Im Regelfall schicken Zahnärzte ihre Patienten mit dem Blutentnahmeset und dem ausgefüllten Anforderungsschein zum Hausarzt, welcher das Blut abnehmen kann. Einige Zahnärzte nehmen auch selbst Blut ab. In Berlin, aber auch in einigen weiteren Großstädten, stehen Ihren Patienten Blutabnahmemöglichkeiten in unseren Kooperationseinrichtungen zur Verfügung. Gerne informieren wir Sie darüber.
Wie wird der LTT abgerechnet?
Die Abrechnung erfolgt durch das Labor direkt mit dem Patienten. Bei Privat-Versicherten ist der LTT unter der Ziffer 3694 abrechenbar. Zahnärzte sind berechtigt, diese Leistungen im Labor zu veranlassen. Im Bereich der Gesetzlichen Krankenversicherung sind LTT-Untersuchungen mit zahnärztlichen Fragestellungen keine Kassenleistungen.
Durchführung des LTT
Beim LTT werden die Lymphozyten im Labor aus einer Blutprobe des Patienten gewonnen und mit den jeweils zu testenden Allergenen in drei parallelen Ansätzen „konfrontiert“. Wenn beim Patienten allergenspezifische T-Lymphozyten vorhanden sind, kommt es innerhalb der nächsten 6 Tage zur klonalen Zellproliferation. Diese wird anhand der DNA-Synthese quantifiziert.
Die Allergen-induzierte Lymphozytenvermehrung wird in Relation zur spontanen Proliferation (Leerwert) gesetzt und ergibt als Ergebnis den Stimulationsindex (SI).
Noch um 2000 hatte der LTT eine relativ geringe Empfindlichkeit. Bei der Diagnostik von Typ IV-Allergien war er dem Hauttest allenfalls gleichwertig, wenn nicht sogar unterlegen.
Die heute in immunologischen Speziallaboratorien angewandten LTT-Technologien zeichnen sich durch eine hohe Sensitivität und Spezifität aus. Dazu beigetragen haben die Weiterentwicklungen der Zellkulturtechniken und -medien, die Reinheit der zur Zellstimulation verwendeten Allergene und die heute zur Verfügung stehenden grundlegend verbesserten Messmethoden für die 3H-Thymidin-Aktivitätsbestimmung.
Zur Entwicklung der Methodik hat die Verwendung von gentechnisch hergestelltem Interferon-α als Zusatz in der Zellkultur beigetragen (von Baehr et al, J. Immunol. Methods 2001; 251: 63-71). Durch diese im Jahre 2005 im IMD Berlin eingeführte optimierte LTT-Variante konnte die Sensitivität und die Spezifität, vor allem im Vergleich zu der damals noch gängigen MELISA®-Methodik, signifikant verbessert werden.
Der LTT ist als Labormethode akkreditiert.
Beim Lymphozyten-Transformations-Test handelt es sich um ein anspruchsvolles Laborverfahren. Neben einer kostenintensiven Laborausstattung sind große Erfahrung und Sorgfalt beim durchführenden Laborpersonal erforderlich, da bei diesem Test nur wenige Arbeitsschritte automatisierbar sind. Die Basis der Zellkultur ist auch in unserem modernen Technologiezeitalter noch die gute alte „Handarbeit“, die durch erfahrene und in der Zellkultur geschulte Mitarbeiter erfolgen muss.
Des Weiteren ist die analytische Qualität vom Grad der Standardisierung im jeweiligen Labor abhängig und von der Methodik die für jedes einzelne Allergen etabliert und validiert wurde. Aus diesem Grund sollten zelluläre Analyseverfahren nur durch speziell darauf orientierte Fachlaboratorien und Institute durchgeführt werden, wo diese Verfahren nach DIN 15189 von der nationalen Akkreditierungsstelle der Bundesrepublik Deutschland (DAkkS) akkreditiert sind.
Im IMD-Berlin wurde der LTT schon 2004 nach DIN 15189 akkreditiert und seitdem regelmäßig überwacht.
Für zahnmedizinische Fragestellungen ist der LTT dem Epikutantest (ECT) vorzuziehen.
Zum Nachweis von Typ IV-Sensibilisierungen stehen mit dem LTT und dem Epikutantest zwei voneinander unabhängige Testmethoden zur Verfügung. Diese können sich bei einigen Fragestellungen (z.B. in der Berufsdermatologie) gut ergänzen. Für zahnmedizinische Fragestellungen ist der LTT dem ECT aber aus den folgenden Gründen vorzuziehen:
- Der LTT ist sensitiver bei systemischen Sensibilisierungen.
Der Epikutantest ist zum Nachweis einer Kontaktallergie validiert, d.h. bei Allergien, wo die Sensibilisierung durch Hautkontakt stattgefunden hat bzw. sich an der Haut manifestiert. Bei Allergenen, die über Schleimhäute aufgenommen werden, spricht man von systemischen Sensibilisierungen. Hier hat der LTT Vorteile hinsichtlich der Sensitivität, da er mit Blutzellen durchgeführt wird.
Mit dieser Begründung wurde der LTT auch für den Nachweis von Sensibilisierungen auf Medikamente in die allergologischen Leitlinien aufgenommen und von der Leitlinienkommission des Robert-Koch-Institut als „uneingeschränkt empfehlenswert“ eingestuft. Auch wenn die dermatologischen Berufsverbände es bis heute in Frage stellen, werden Allergene aus Zahnersatzmaterialien ähnlich wie Medikamente über die Schleimhäute und nicht über die äußere Hautbarriere aufgenommen.
Der logische Schluss, hier ebenfalls den LTT zu empfehlen, scheitert bisher wohl eher an der fehlenden Wertschätzung der Problematik „Unverträglichkeit von Zahnersatzmaterial“ als an immunpathologischen Argumenten gegen den LTT.
Die Sensitivität des LTT wird heute mit 90 bis 95% in Abhängigkeit vom Testallergen angegeben. Die Spezifität ist abhängig von der Validierung jedes einzelnen Allergens und der Qualität der LTT-Durchführung. In einem nach DIN 15189 akkreditierten Labor sind falsch positive Befunde durch unspezische Aktivierungen durch interne Standardisierung auszuschließen. - Beim LTT kommt der Patient nicht mit dem Allergen in Kontakt.
Durch den beim Epikutantest unvermeidbaren direkten Kontakt des Patienten mit dem Allergen kann dieser durch den Test selbst sensibilisiert werden. Das ist beim LTT nicht möglich, da die „Konfrontation“ an einer entnommenen Blutprobe im Labor stattfindet. Problematisch beim Epikutantest ist, dass im Falle einer stattfindenden Sensibilisierung, diese in dem betreffenden Epikutantest nicht zu erkennen ist.
Erst mit einem zweiten Epikutantest, frühestens 10-14 Tage später, wäre die Sensibilisierung nachweisbar. Diese zweite „Testung“ führt aber paradoxerweise dann der Zahnarzt durch, wenn er das Ersatzmaterial in den Organismus einbringt. Daher ist der Epikutantest für vorbeugende Testungen sogar kontraindiziert.
Auch karzinogene und toxische Substanzen sollten nie auf die Haut eines Patienten aufgebracht werden, weshalb sich ihr Einsatz im Epikutantest verbietet.
Die Kommission „Methoden und Qualitätssicherung“ des Robert-Koch-Institutes fasst die Vorteile
„Qualitätssicherung beim Lymphozytentransformationstest“ - Addendum zum LTT-Papier der RKI-Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“ Mitteilung der Kommission „Methoden und Qualitätssicherung in der Umweltmedizin“ Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz 2008;51:1070-1076 |
Stellungnahme des Deutschen Berufsverbandes der Umweltmediziner (PDF)
Titanunverträglichkeit
Titan zeichnet sich durch ein hervorragendes Korrosionsverhalten aus und hat dadurch eine im Vergleich zu anderen Metallen gute immunologische Verträglichkeit. Allerdings weiß man, dass bei einigen Patienten die Implantate unerwünschte Entzündungserscheinungen induzieren, die zur fehlenden knöchernen Integration, Perigingivitis und Periimplantitis führen können.
Echte zelluläre Typ IV-Allergien auf Titan stellen im Unterschied zu anderen Metallen eine Rarität dar. Die Ursache dafür ist, dass Titanionen durch ihre hohe Sauerstoffaffinität unmittelbar nach ihrer Freisetzung Oxide bilden und im Unterschied zu freien Ionen können diese Oxide keine Proteinbindung eingehen und somit keine allergene (haptene) Wirkung entfalten. Die häufig gemachte Aussage, dass es „auf Titan keine Allergien gibt“, ist aus streng immunologischer Sicht somit sehr wahrscheinlich richtig. Allergien sind jedoch nicht die einzige Ursache von immunologisch bedingten Unverträglichkeiten. Die häufigste Ursache der individuellen Überempfindlichkeit gegenüber Titan ist eine überschießende proentzündliche Reaktivität der Gewebemakrophagen.
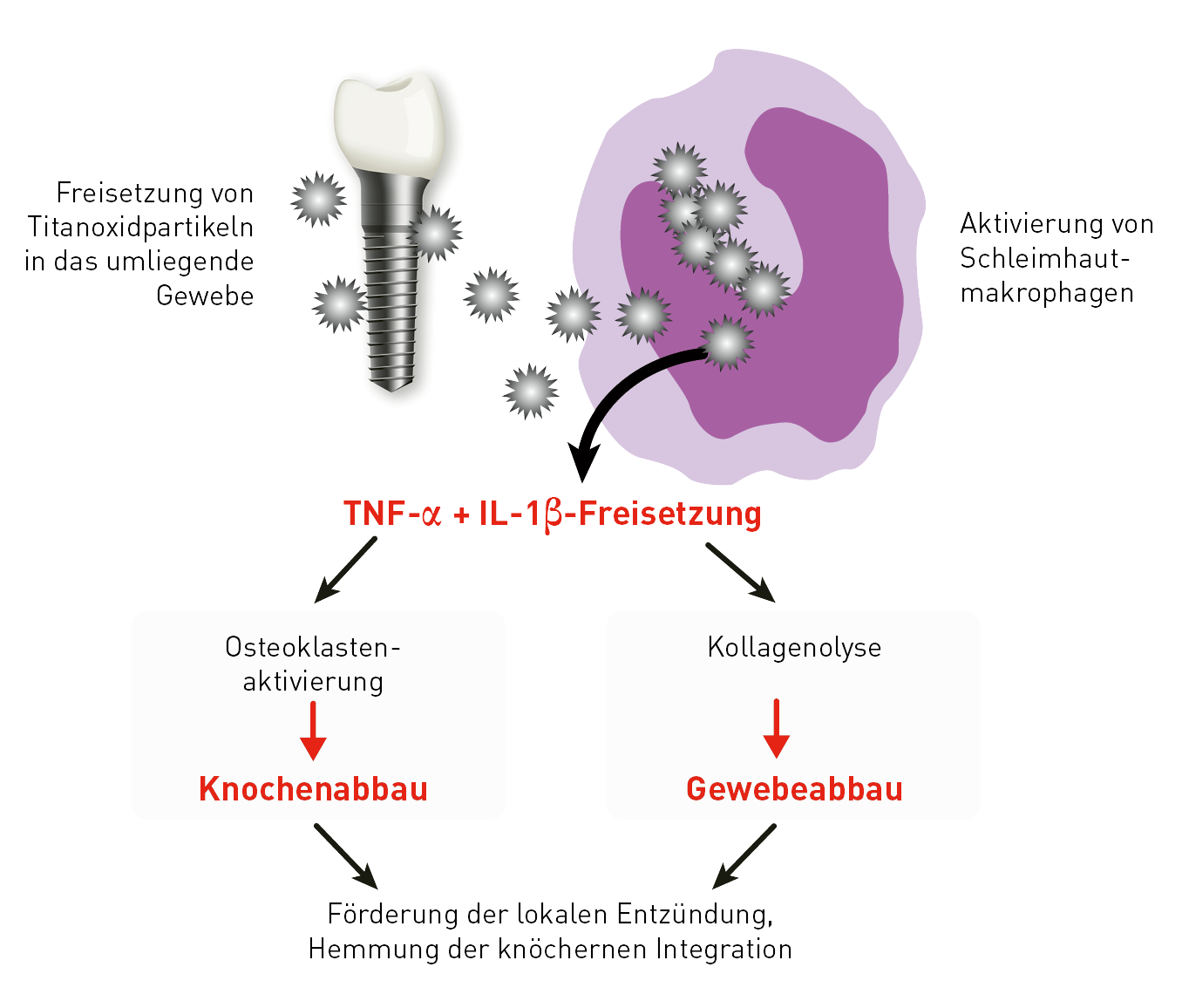
An der Oberfläche implantierter Titanmaterialien findet metallischer Abrieb statt. Titanoxidpartikel sind daher nahezu immer im umgebenden Knochen- oder Weichgewebe des Implantats zu finden. Die Gewebemakrophagen („Abräumzellen“) phagozytieren diese Titanoxidpartikel (partikulärer Debris). Es ist physiologisch, dass Makrophagen nach Kontakt mit Titanoxidpartikeln mit der Freisetzung proentzündlicher Zytokine, im wesentlichen TNF-α und Interleukin-1, reagieren. Sehr individuell ist allerdings das Ausmaß dieser Immunantwort. Die Intensität der Zytokinfreisetzung hängt u.a. von genetischen Varianten (Polymorphismen) der beteiligten proentzündlichen (IL-1 und TNF-α) und antientzündlichen (IL-1RN) Mediatoren ab. Die Titanunverträglichkeit ist daher meist die Folge einer gesteigerten Entzündungsbereitschaft der Gewebemakrophagen auf Titanoxidpartikel. Titan-spezifische Lymphozyten spielen hier keine Rolle, was die negativen LTT- und Epikutantest-Ergebnisse erklärt.

Der Titan-Stimulationstest wurde für diese Fragestellung entwickelt und umfassend validiert. Bei diesem Vollblutstimulationstest wird untersucht, ob die Monozyten/Makrophagen des Patienten nach Kontakt mit Titanpartikeln mit einer gesteigerten Entzündungsantwort reagieren. Diese ist erkennbar an einer erhöhten Freisetzung der beiden proentzündlichen Schlüsselzytokine TNF-α und/oder IL-1β. Bei Patienten mit positiven Befunden ist eine verzögerte oder gestörte Einheilung von dentalen Titanimplantaten dadurch zu erklären, dass auch die Makrophagen im Implantationsgebiet auf frei werdende Titanpartikel hyperaktiv reagieren und primär eine lokale, ggf. auch eine systemische Entzündung induzieren.
Mit steigendem genetischen Entzündungsgrad steigt auch das Risiko für ein Titan-assoziiertes Entzündungsgeschehen.
Inzwischen ist für funktionell relevante Polymorphismen in den Genen der Zytokine IL-1, IL-1RN und TNF-α in einer Vielzahl von Studien der Zusammenhang zur Periimplantitis bzw. zum Implantatverlust gezeigt. Ungefähr 15 bis 20 % der Bevölkerung reagieren genetisch determiniert mit einer ausgesprochen starken Entzündungantwort. Die verantwortlichen Polymorphismen in den Genen für TNF-α, IL-1 und IL1-RN können im Labor nachgewiesen werden.
Dieses molekulargenetische Verfahren hat den Vorteil, dass es nicht von aktuellen Entzündungsgeschehen oder immunsuppressiven Therapien beeinflusst wird. Die genetische Testung erlaubt an Hand der gefundenen Polymorphismenkombination die Zuordnung zu einem Entzündungsgrad. Der genetische Entzündungsgrad steigt abhängig von der Anzahl der vorliegenden Polymorphismen von Grad 0 (kein Polymorphismus liegt vor, normale Entzündungsneigung) bis auf Grad 4 (alle vier untersuchten Polymorphismen liegen vor, deutlich erhöhte Entzündungsneigung). Patienten mit Grad 3 und 4 gelten als High-Responder und somit als Risikopatienten für ein Titan-assoziiertes dentales Entzündungsgeschehen / Implantatverlust.
Die klinische Relevanz dieser Polymorphismen ist auch durch den Fakt gesichert, dass Patienten mit High-Responder-Polymorphismen eine erhöhte Empfindlichkeit für einen periprosthetischen Knochenverlust aufweisen. Wichtig ist zu betonen, dass es sich bei den Genpolymorphismen um angeborene Prädispositionsfaktoren handelt, die anders als bei der Allergie, keinen Erstkontakt benötigen ehe sie im Labortest nachweisbar sind. Demzufolge können sowohl der Titanstimulationstest als auch die genetischen Analysen präventiv, d.h. im Rahmen der Implantationsplanung eingesetzt werden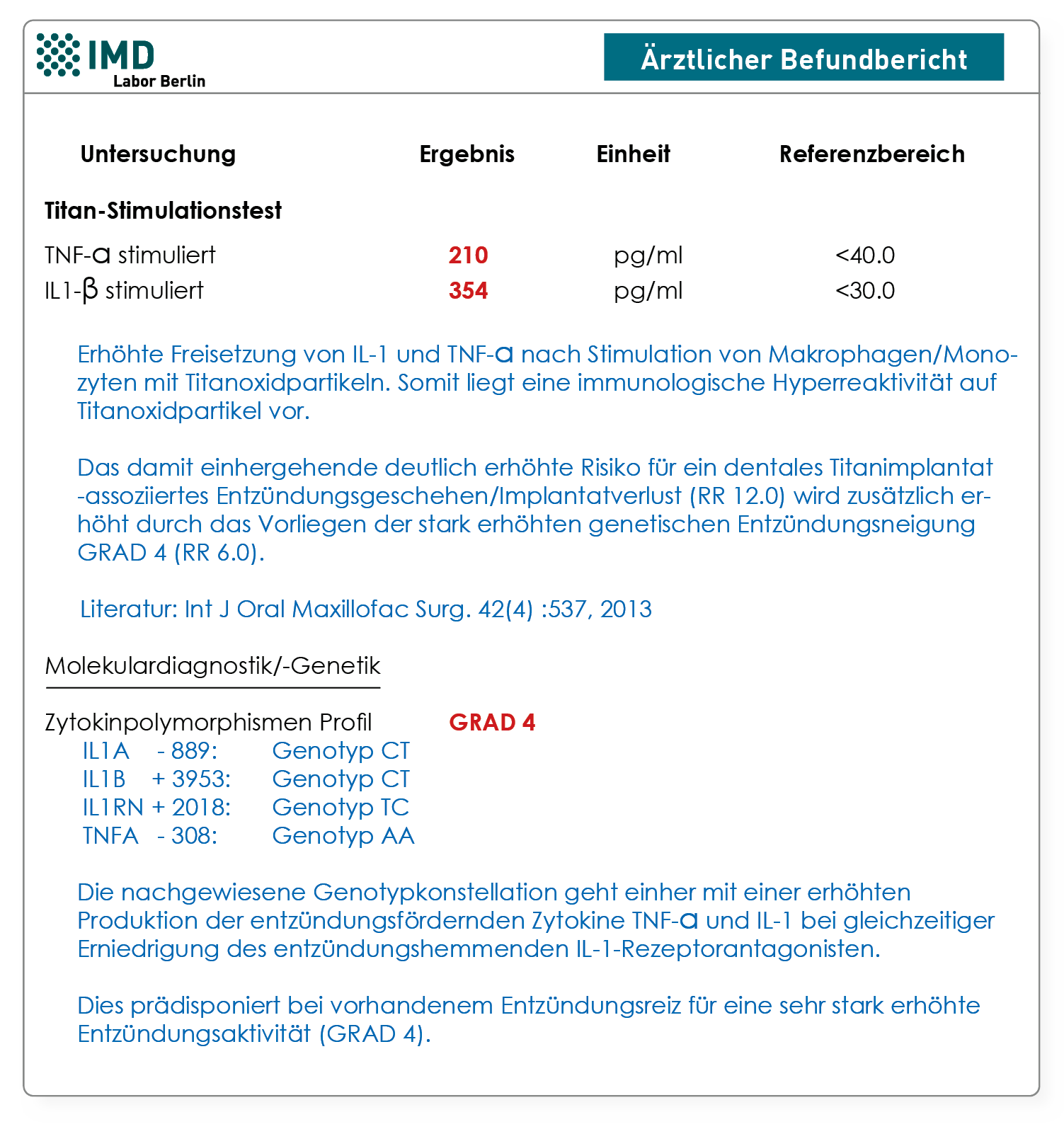
einer Studie, die von der Deutschen Gesellschaft für Umwelt-ZahnMedizin (DEGUZ) initiiert wurde, konnte die prognostische Aussagekraft beider Analysen bestätigt werden (Dr. Jacobi-Gresser et al. 2012). Im Vergleich zur Kontrollgruppe (Patienten bei denen Implantate seit mehr als 5 Jahren komplikationslos eingeheilt sind) zeigen Patienten mit Implantatverlust ohne Belastung in der Einheilphase sowie Patienten mit Implantatverlust nach Belastung eine signifikant höhere in vitro-Titanoxid-induzierte TNF-α und IL-1β-Freisetzung im Titanstimulationstest (p<0.0001). Ein positiver Titanstimulationstest stellt ein vom Alter, Geschlecht und Raucherstatus unabhängigen Risikofaktor dar und erhöht das Risiko für ein Titan-assoziiertes Entzündungsgeschehen / Implantatverlust um das zwölffache.
Darüber hinaus hat die Anzahl an Risiko-Polymorphismen und somit der daraus resultierende genetische Entzündungsgrad einen signifikanten Einfluss auf den Implantatverlust (p* = 0.046). Mit steigendem genetischem Entzündungsgrad steigt auch das Risiko für ein Titan-assoziiertes dentales Entzündungsgeschehen/Implantatverlust auf das bis zu sechsfache.
| Relatives Risiko für einen dentalen Titanimplantatverlust | |
|---|---|
| Negativer Titanstimulationstest | 1.0 |
| Positiver Titanstimulationstest | 12.0 |
| Genetischer Entzündungsgrad 0 | 1.0 |
| Genetischer Entzündungsgrad 1 | 1.5 |
| Genetischer Entzündungsgrad 2 | 2.4 |
| Genetischer Entzündungsgrad 3 | 3.8 |
| Genetischer Entzündungsgrad 4 | 6.0 |
Erläuterung: Ein Patient mit positivem Titanstimulationstest hat ein zwölffach erhöhtes Risiko im Vergleich zur Normalbevölkerung. Trägt er zusätzlich den genetischen Entzündunsgrad 4, steigt das Risiko nochmals um das sechsfache.
Ein auffälliges Ergebnis in einer der beiden Untersuchungen kennzeichnet das Vorliegen einer deutlichen Prädisposition für ein Titan-assoziiertes Entzündungsgeschehen, welches mit einem primären oder sekundären Implantatverlust verbunden sein kann. Es ist nicht gleichzusetzen mit einer Allergie, bei der das Allergen grundsätzlich zu meiden wäre. Ein positiver Titanstimulationstest oder ein Entzündungsgrad 2 bis 4 stellt also für sich allein keine absolute Kontraindikation für ein Titanimplantat dar.
Es sollten aber in diesen Fällen Alternativen (z.B. Keramikimplantate, herausnehmbarer Zahnersatz, beschichtete Titanimplantate) kritisch geprüft und prophylaktische Maßnahmen intensiviert werden (Prophylaxe, Verwendung niedriger Drehzahlen, keine Verwendung von Parodontalsonden aus Titan, keine Sofortimplantation, Herdsanierung, Raucherentwöhnung, optimale Einstellung anderer prädisponierender Erkrankungen (z.B. Diabetes mellitus), keine Mehrfachimplantationen, bis 4 Wochen nach Implantation Vermeidung jeglicher Immunstimulation). Gegebenenfalls können immunsupressive Maßnahmen zum Zeitpunkt der Implantateinbringung förderlich sein.
Benötigtes Probenmaterial
Titanstimulationstest: 10 ml Heparinblut. Die Heparinmonovetten aus den LTT-Abnahmesets können verwendet werden. Gern senden wir Ihnen auch einzelne Abnahmeröhrchen zu. Ein Probeneingang im Labor innerhalb von 24h muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden.
Genetische Entzündungsneigung: 2 ml EDTA-Blut oder 2 Mundschleimhautabstriche. Für die genetische Untersuchung benötigen wir die Einverständniserklärung des Patienten. Der Transport ins Labor ist nicht zeitkritisch und kann per Postversand erfolgen.
Abrechnung
Die beiden Untersuchungen gehören nicht zum Leistungsspektrum der Gesetzlichen Krankenversicherungen (GKV). Privatkassen übernehmen bei gegebener Indikation die Kosten. Privatversicherte Patienten entnehmen bitte für den Titanstimulationstest und die Genetische Entzündungsneigung den jeweiligen Betrag dem aktuellen Anforderungsschein.
Selbstzahler entnehmen bitte die Kosten für den Titanstimulationstest und die Genetische Entzündungsneigung diesem aktuellen Anforderungsschein.
Sollte zusätzlich der LTT im Vorfeld einer Implantation oder bei Verdacht auf Titanunverträglichkeit durchgeführt werden?
Typ IV-Sensibilisierungen auf Titan sind wie schon erwähnt ausgesprochen selten, was an der hohen Oxidationstendenz des Titans liegt. Somit steht der LTT für zahnmedizinische Fragestellungen in seiner Bedeutung eindeutig hinter dem Titanstimulationstest zurück. Im Hinblick auf Typ IV-Sensibilisierungen sind verunreinigende Metalle mit Sicherheit von größerer Relevanz. Aus Titanimplantaten älteren Fabrikats können Spuren an Nickel, Vanadium oder Aluminium freigesetzt werden. Aus diesem Grund wurde ergänzend zum Titanstimulationstest ein LTT-Screening-Profil entwickelt, mit welchem zusätzlich zum Titan auch diese drei Metalle getestet werden können.
Benötigtes Probenmaterial
LTT-Titan/Aluminium/Nickel/Vanadium: 20 ml Heparin- und 5 ml Vollblut (LTT-Abnahmesets verwenden!)
Ein Probeneingang im Labor innerhalb von 24h muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden.
Abrechnung
LTT-Titan (Titan, Aluminium, Vanadium, Nickel): Die Untersuchung gehört nicht zum Leistungsspektrum der Gesetzlichen Krankenversicherungen (GKV). Selbstzahler entnehmen die Kosten bitte dem aktuellen Anforderungsschein und privatversicherte Patienten diesem aktuellen Anforderungsschein. Privatkassen übernehmen bei gegebener Indikation die Kosten.
- Alvim-Pereira F, Montes CC, Mira MT, Trevilatto PC. Genetic susceptibility to dental implant failure: a critical review. Int J Oral Maxillofac Implants. 2008;23(3):409-416.
- Andus T, Daig R, Vogl D, Aschenbrenner E, Lock G, Hollerbach S, Köllinger M, Schölmerich J, Gross V. Imbalance of the interleukin 1 system in colonic mucosa-association with intestinal inflammation and interleukin 1 receptor antagonist genotype 2. Gut. 1997;41(5):651-657.
- Assuma R, Oates T, Cochran D, Amar S, Graves DT. IL-1 and TNF antagonists inhibit the inflammatory response and bone loss in experimental periodontitis. J Immunol. 1998;160(1):403-409.
- Campos M I, Santos M C, Trevilatto P C, Scarel-Caminaga R M, Bezerra F J, Line S R. Evaluation of the relationship between interleukin-I gene cluster polymorphisms and early implant failure in non-smoking patients. Clin Oral Implants Res. 2005;16(2):194–201.
- Dörner T, Haas J, Loddenkemper C, von Baehr V, Salama A. Implant-related inflammatory arthritis. Nat Clin Pract Rheumatol. 2006;2(1):53-56.
- Dominici R, Cattaneo M, Malferrari G, Archi D, Mariani C, Grimaldi LM, Biunno I. Cloning and functional analysis of the allelic polymorphism in the transcription regulatory region of interleukin-1 alpha. Immunogenetics. 2002;54(2):82-86.
- Esposito M, Hirsch JM, Lekholm U, Thomsen P. Biological factors contributing to failures of osseointegrated oral implants. (II). Etiopathogenesis. Eur J Oral Sci. 1998;106(3):721-764.
- Jacobi-Gresser L, Huesker K, Schuett S. Genetic and immunological markers predict titanium implant failure - a retrospective study. J Oral Maxillofac Surg. 2013;42:537-543
- Jansson H, Hamberg K, De Bruyn H, Bratthall G. Clinical consequences of IL-1 genotype on early implant failures in patients under periodontal maintenance. Clin Implant Dent Relat Res. 2005;7(1):51–59.
- Kaufman AM, Alabre CI, Rubash HE, Shanbhag AS. Human macrophage response to UHMWPE, TiAlV, CoCr, and alumina particles: analysis of multiple cytokines using protein arrays. J Biomed Mater Res A. 2008;84(2):464-474.
- Laine M L, Leonhardt A, Roos-Jansäker A M, Pena A S, V. Winkelhoff A J, Winkel E G, Renvert S. IL-1RN gene polymorphism is associated with peri-im-plantitis. Clin Oral Implants Res. 2006;17(4):380–385.
- McDermott NE, Chuang SK, Woo VV, Dodson TB. Complications of dental implants: identification, frequency, and associated risk factors. Int J Oral Maxillofac Implants. 2003;18(6):848-855.
- Montes CC, Pereira FA, Thomé G, Alves ED, Acedo RV, de Souza JR, Melo AC, Trevilatto PC. Failing factors associated with osseointegrated dentalimplant loss. Implant Dent. 2007;16(4):404-412.
- Montes CC, Alvim-Pereira F, de Castilhos BB, Sakurai ML, Olandoski M, Trevilatto PC. Analysis of the association of IL1B (C+3954T) and IL1RN (intron 2) polymorphisms with dental implant loss in a Brazilian population. Clin Oral Implants Res. 2009;20(2):208-217.
- Nakashima Y, Sun DH, Trindade MC, Maloney WJ, Goodman SB, Schurman DJ, Smith RL. Signaling pathways for tumor necrosis factor-alpha and interleukin-6 expression in human macrophages exposed to titanium-alloy particulate debris in vitro. J Bone Joint Surg Am. 1999;81(5):603-615.
- Perala D G, Chapman R J, Gelfand J A, Callahan, M V, Adams D F, Lie T. Relative production of IL-1b and TNF-α by mononuclear cells after exposure to dental implants. J Periodontol. 1992;63(5):426–430.
- Shimpuku H, Nosaka Y, Kawamura T, Tachi Y, Shinohara M, Ohura K. Genetic polymorphisms of the interleukin-1 gene and early marginal bone loss around endosseous dental implants. Clin Oral Implants Res. 2003;14(4):423–429.
- Sterner T, Schütze N, Saxler G, Jakob F, Rader CP. Effects of clinically relevant alumina ceramic, zirconia ceramic and titanium particles of different sizes and concentrations on TNF-alpha release in a human macrophage cell line. Biomed Tech. 2004;49(12):340-344.
- Toljanic JA, Banakis ML, Willes LA, Graham L. Soft tissue exposure of endosseous implants between stage I and stage II surgery as a potential indicator of early crestal bone loss. Int J Oral Maxillofac Implants. 1999;14(3):436-441.
- Wilson AG, Symons JA, McDowell TL, McDevitt HO, Duff GW. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci. 1997;94(7):3195-3199.
Nachweis von Soforttypallergien
Im Unterschied zu Metallen, wo allergische Unverträglichkeitsreaktionen ausschließlich auf lymphozytär vermittelte Typ IV-Sensibilisierungen zurückzuführen sind, können Immunreaktionen gegenüber acrylathaltigen Kompositmaterialien sowie auch anderen nicht-metallischen Werkstoffen auch IgE-vermittelt (Typ I-allergisch) sein.
An Soforttypallergien sollte gedacht werden, wenn die Symptomatik innerhalb weniger Stunden (selten sogar Minuten) nach Einbringung nicht-metallischer Zahnersatzmaterialien auftritt. Typisch sind lokale aber auch systemische ödematöse, quaddelartige Schleimhautaffektionen, wobei diese auf Grund der Besonderheiten der Schleimhäute lokal selten eine typische Morphe haben.
In der Literatur finden sich Hinweise, dass Patienten mit bekannten Soforttypallergien (Heuschnupfen, Insektengift- und Hausstauballergien) häufiger auch von einer Acrylatallergie betroffen sind, was auf eine prinzipielle Prädisposition für Typ I-Allergien hindeutet.
Wie erfolgt die Testung im Labor?
Für viele klassische Typ I-Allergene (z. B. Baumpollen) kann das spezifische IgE automatisiert in nahezu jedem Labor über EAST oder RAST-Verfahren bestimmt werden. Acrylate oder z.B. Inhalte von Wurzelfüllmaterialien sind allerdings bisher von keinem kommerziellen Anbieter etabliert worden. Die Diagnostik ist daher heute ausschließlich über zelluläre Testsysteme möglich.
Der Basophilenaktivierungstest (BAT) ist eine moderne in-vitro-Methode zum Nachweis Typ I-allergischer Sensibilisierungen sowie von Pseudoallergien. Der Test ist auch als Leukotrien-Release-Test, Basophilen-Aktivierungstest oder CAST-Test bekannt. Vorteil dieses Testes ist, dass sowohl Standardallergene (z.B. Acrylatmonomere) als auch native Materialproben nach Aufarbeitung im Labor getestet werden können. Dieses ermöglicht z.B. die Testung von Materialproben unbekannter Zusammensetzung (einschließlich von Prothesenmaterial oder in situ gewonnenen Kunststoffspänen).
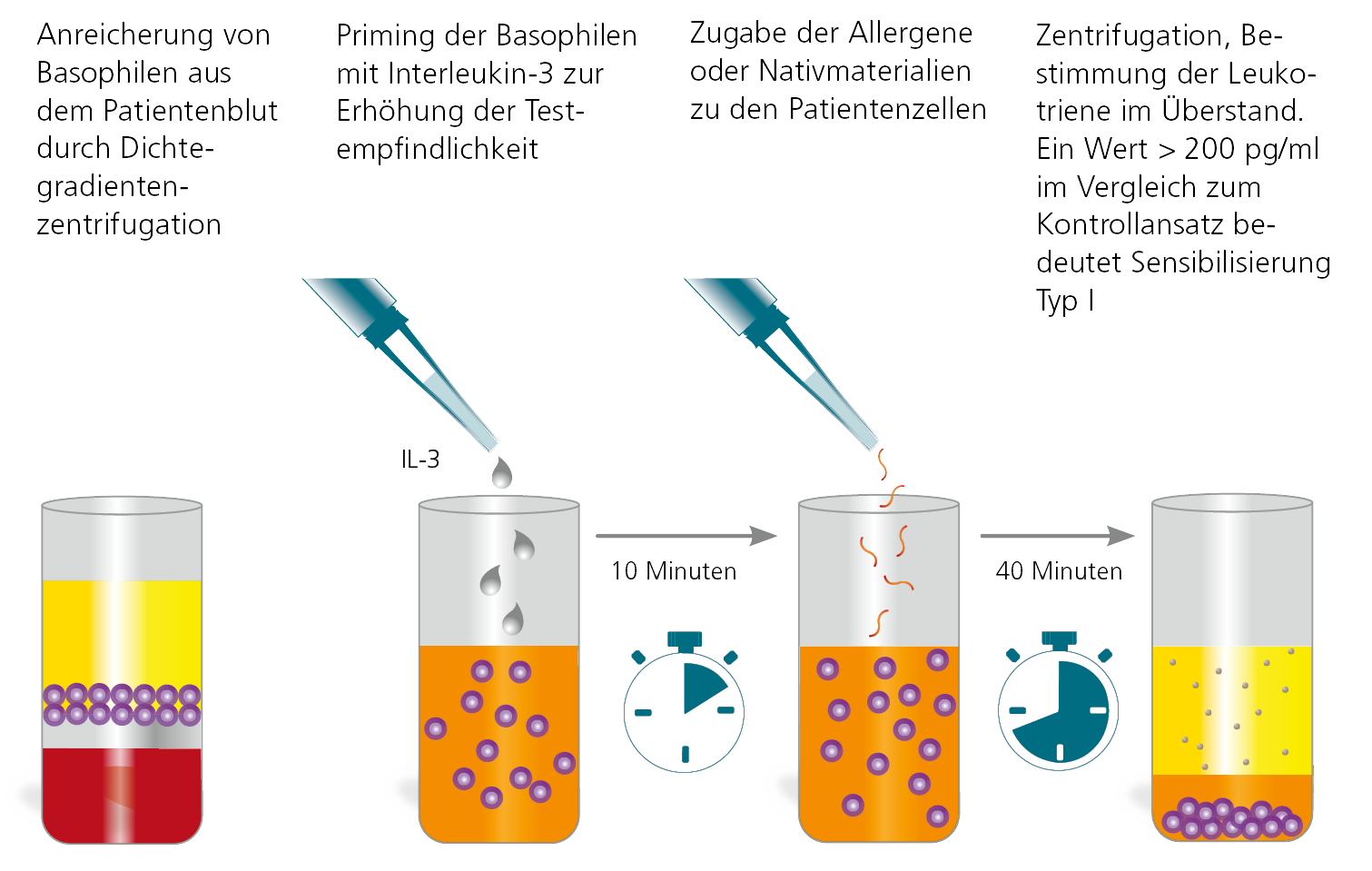
Abb. 1 Der BAT ist ein innovativer Labortest, bei dem in vitro (d.h. ohne Gefährdung des Patienten) eine Soforttypsensibilisierung bewiesen oder auch ausgeschlossen werden kann.
Die Ergebnisse der Allergen-stimulierten Testansätze werden mit Positiv- und Negativkontrollen ins Verhältnis gesetzt. Ein resultierender Wert über 200 pg/ml bedeutet, dass eine Sensibilisierung vom Typ I vorliegt. Ein negatives Resultat schließt eine Sofort-Typ-Sensibilisierung mit hoher Sicherheit aus.
Hinsichtlich Sensitivität und Spezifität hat sich in unserem Labor der BAT gegenüber anderen in vitro-Provokationstesten wie Histamin-Freisetzungs-Test oder CD63-Test als eindeutig überlegen erwiesen.
Welche Zahnersatzmaterialien sind im BAT testbar?
Das Standard-Acrylat-Profil enthält:
- Methylmethacrylat (MMA)
- 2-Hydroxyethylmethacrylat (HEMA)
- Triethylenglycoldimethacrylat (TEGDMA)
- 2,2-Bis-(4-(2-Hydroxy-3-methacryloxypropoxy)-phenyl)propane (BISGMA)
Alle weiteren gängigen Acrylate sind im Labor für die Testung vorrätig.
Auch Nativ-Proben können im BAT getestet werden.
Es ist allerdings auch möglich, eine Materialprobe (Kunststofftestplättchen, Proben von Wurzelfüllmaterialien, nativ gewonnene Späne, Zementproben o.ä.) mit ins Labor zu senden, auf welche dann direkt im BAT getestet wird. Das Material muss gemeinsam mit dem Blut eingesandt werden. Eine Reihe von Materialien sind im Labor auch vorrätig und für die Testung etabliert (siehe Rückseite des Anforderungsscheines Zahnmedizin). Vor allem bei Präventivtestungen sollten die Materialien in dem Zustand getestet werden, in dem sie später auch beim Patienten eingesetzt werden (z. B. ausgehärteter Kompositzement, auspolymerisierter Kunststoff).
Benötigtes Probenmaterial
2 ml EDTA-Blut oder Heparinblut pro Allergen bzw. Nativmaterial. Die Heparinmonovetten aus dem LTT-Abnahmeset können verwendet werden. Gerne senden wir Ihnen auch einzelne Abnahmeröhrchen zu. Ein Probeneingang im Labor innerhalb von 24h muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden.
Abrechnung
Die Kosten betragen für Selbstzahler je hausinternen Allergen 18,65 € und je externen Allergen 29,14 €. Dazu einmalig für die Zelltrennung für Selbstzahler 23,31 € und für privatversicherte Patienten 2681 €.
Für privatversicherte Patienten betragen die Kosten je hausinternen Allergen 21,45 € und je externen Allergen 33,52 €.
Privatkassen übernehmen bei gegebener Indikation die Kosten.
Überempfindlichkeiten auf Lokalanästhetika können allergischen Ursprungs sein.
Vor allem wenn die Symptomatik innerhalb von Minuten bis wenigen Stunden eintritt, muss an IgE-vermittelte Sensibilisierungen oder Pseudoallergien gedacht werden. Anaphylaxien, d. h. systemische, zum Teil lebensgefährliche Überempfindlichkeitsreaktionen sind beschrieben. Bei Verdacht auf eine Unverträglichkeit auf Lokalanästhetika sollte eine Testung der Präparate im BAT erfolgen.
Im BAT sind prinzipiell alle Präparate einsetzbar, wenn eine Ampulle oder Tablette mit eingesandt wird. Folgende Wirkstoffe von Lokalanästhetika sind im Labor vorrätig und müssen deshalb nicht mit eingeschickt werden: Mepivacain, Articain, Lidocain, Prolocain und Ubistesin. Bei positiven Befunden wird ein Allergiepass ausgestellt. Ein positiv getestetes Präparat sollte prinzipiell nicht verwendet werden.

Benötigtes Probenmaterial
2 ml EDTA-Blut oder Heparinblut pro Präparat
Die Heparinmonovetten aus dem LTT-Abnahmeset können verwendet werden. Gerne senden wir Ihnen auch einzelne Abnahmeröhrchen zu. Ein Probeneingang im Labor innerhalb von 24h muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden.
Abrechnung
Die Kosten betragen für Selbstzahler je Präparat 18,65 € (+ einmalig 23,31 € für die Zelltrennung). Für Privat versicherte Patienten betragen die Kosten je Präparat 21,45 € (+ einmalig 26,81 € für die Zelltrennung).
- Kanerva L. Cross-reactions of multifunctional methacrylates and acrylates. Acta Odontol Scand. 2001;59:320-329.
- Lindström M, Alanko K, Keskinen H, Kanerva L. Dentist's occupational asthma, rhinoconjunctivitis, and allergic contact dermatitis from methacrylates. Allergy. 2002;57:543-545.
- Piirilä P, Hodgson U, Estlander T, Keskinen H, Saalo A, Voutilainen R, Kanerva L. Occupational respiratory hypersensitivity in dental personnel. Int Arch Occup Environ Health. 2002;75:209-216.
- Sanz ML, Gamboa P, de Weck AL. A new combined test with flowcytometric basophil activation and determination of sulfidoleukotrienes is useful for in vitro diagnosis of hypersensitivity to aspirin and other nonsteroidal anti-inflammatory drugs. Int Arch Allergy Immunol. 2005;136:58-72.
- de Weck AL, Sanz ML.Cellular allergen stimulation test (CAST) 2003, a review. J Investig Allergol Clin Immunol. 2004;14:253-273.