Die Darmbarriere
… und was Stuhlanalysen über sie verraten
Bei vielen Patienten mit unspezifischen gastrointestinalen Symptomen ist die Barrierefunktion der Darmschleimhaut gestört. Dieses resultiert nicht nur in einer unselektiven Aufnahme von Bakterienbestandteilen oder unverdauten (entzündungsstimulierenden) Nahrungsbestandteilen oder Schadstoffen sondern auch in einer Störung des sehr stark regulierten Stoffaustausches.
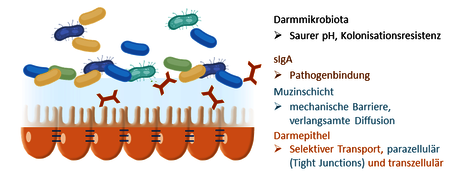
Die Aufgabe der Darmschleimhaut besteht darin, das Gleichgewicht zwischen der Aufnahme von Ionen und Nährstoffen und dem Schutz der umliegenden Gewebe vor dem Eindringen von Mikroorganismen, Toxinen und Antigenen aus der Nahrung zu schützen. Die intestinale Barriere wird häufig als einlagige Zellschicht von Kolonozyten dargestellt, sie beinhaltet aber zusätzliche Ebenen (Abb. 2).
Vom Darmlumen aus betrachtet, stellen die erste Ebene der Barriere die kommensalen Bakterien dar. Sie verhindern allein durch ihre Präsenz, dass sich Pathogene ansiedeln können und unterdrücken ihre Vermehrung, in dem sie ein saures Milieu schaffen, auf das viele Pathogene sensibel reagieren.
Abb. 2 Die Ebenen der Darmbarriere. Von unten nach oben: Darmepithelzellen mit Tight Junctions, Muzinschicht mit sIgA, Lumen mit Darmbakterien.
Die Muzinschicht
Die darunterliegende Darmschleimschicht (Muzinschicht) besteht hauptsächlich aus Glykoproteinen (insbesondere Mucin 2 [Muc2]), die von epithelialen Becherzellen abgesondert werden. Diese viskoelastische Schicht erschwert das Vordringen von Antigenen (mikrobiellen Ursprungs oder Lebensmittelantigene) zu den Epithelzellen. Die Schleimschicht des Dickdarms besteht aus einer dichten, inneren und einer lockeren äußeren Schicht. Der äußere Bereich ist von kommensalen Bakterien besiedelt, die gemeinsam mit den Glykoproteinen der Muzinschicht einen großen Teil des sekretorisches Immunglobulins A (sIgA), das ein wesentlicher Bestandteil des intestinalen Immunsystems ist, in der Muzinschicht verankert.
Die innere Schicht ist viel dichter gepackt, enthält keine Bakterien und stellt vor allem eine physikalische Barriere dar.
Zahlreiche Faktoren wie Zytokine, Bakterien (insbesondere Akkermanisa muciniphila) und ihre Stoffwechselprodukte sowie Toxine können den Muzinumsatz, einschließlich Produktion, Sekretion und Abbau, modulieren und somit die Muzinbarriere beeinflussen.
Das Darmepithel
Die Darmepithelzellen selbst sind durch Zell-Zell-Kontakte miteinander verbunden, zu denen die sogenannten Tight Junctions gehören. Der Transfer von Substanzen erfolgt im intakten Epithel hoch selektiv entweder durch aktive Transportprozesse durch die Zellen hindurch (transzellulär) oder über die Poren der Tight Junctions (also parazellulär). Über den letzteren Weg werden im gesunden Darm primär kleinere Moleküle wie Wasser und Ionen ausgetauscht. Auf dem transzellulären Weg werden Antigene aus dem Darmlumen hin zu den Immunzellen in der Lamina propria geschleust.
Die Öffnung der Tight Junctions wird, soweit bekannt, über proinflammatorische Zytokine und über Zonulin reguliert. Zonulin ist ein humanes Homolog zum Zonula-Occludens-Toxin, ein in Vibrio cholera entdecktes Enterotoxin, das in der Lage ist, intrazelluläre Tight junctions reversibel zu öffnen. Die Ausschüttung von Zonulin kann durch pathogene Bakterien, einige Nahrungsmittelantigene, insbesondere durch die Weizenbestandteile Gluten und Gliadin sowie durch proentzündliche Zytokine induziert werden.
Eine unkontrollierte Mehrausschüttung von Zonulin bewirkt eine dauerhafte Öffnung des parazellulären Transports und ermöglicht es größeren Molekülen, wie bakterielle Metabolite und Lebensmittelantigene, die Darmepithelschicht zu überwinden. Erhöhte Zonulin-Werte korrelieren mit der Symptomatik eines leaky gut und wurden unter anderem bei Patienten mit Morbus Chron, Morbus Parkinson, Reizdarmsyndrom und Zöliakie gefunden.
Diagnostik der Darmbarriere
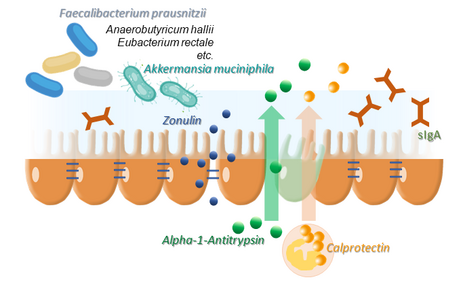
Bei der Stuhldiagnostik stehen, anders als bei der Blutdiagnostik, diverse Marker zur Verfügung, um die beschriebenen Ebenen der Darmbarriere abbilden zu können (Abb. 3).
Der Nachweis kommensaler Bakterien, insbesondere ihre Vielfalt (Diversität) und Balance (Symbiose vs. Dysbiose), geben Aufschluss über die Kolonisationsresistenz, also wie gut die Ansiedlung pathogener Keime verhindert werden kann. Der spezifische Nachweis von butyratbildenden und mukosaprotektiven Bakterien erlaubt indirekte Rückschlüsse auf den Zustand der Muzinschicht und die Energieversorgung der Epithelzellen.
Sektretorisches Immunglobulin A ist kein klassischer Entzündungsmarker, aber als zentraler Bestandteil des Darmimmunsystems deuten erhöhte Werte auf eine Belastung der Darmschleimhaut mit Pathogenen oder Lebensmittelantigenen hin, die oft lokale Entzündungen zur Folge haben.
Das Vorliegen einer akuten Entzündung im Darm lässt sich über die Diagnostik von Calprotectin nachweisen. Calprotectin ist ein Calcium- und Zinkbindendes Protein mit antimikrobiellen Eigenschaften. Es stammt (wie auch Lactoferrin) hauptsächlich aus neutrophilen Granulozyten und macht dort 60% des löslichen Proteingehalts aus. Erhöhte Werte im Stuhl sind Folge einer vermehrten Einwanderung von Granulozyten in die Darmwand und das darunter liegende Gewebe. Ursächlich für diese Einwanderung sind Entzündungsreize, sei es aufgrund von Infektionen, entzündlichen Darmerkrankungen, Medikamenten oder Neoplasien. Calprotectin ist darüber hinaus sehr homogen im Darm, also auch im Stuhl, verteilt, resistent gegen enzymatischen Abbau und bei Raumtemperatur mindestens für drei Tage stabil. Der Nachweis von Calprotectin eignet sich daher sehr gut als Screening-Methode zur Erkennung von entzündlichen Darmerkrankungen.
Erhöhte Calprotectin-Werte im Stuhl (> 50 µg/g) sind bei Morbus Chron und Colitis Ulcerosa aber nicht bei Reizdarm beschrieben worden.
Eine hohe Menge von Zonulin-Peptiden zeigt, wie oben beschrieben, eine Fehlregulation der Tight Junctions an. Eine erhöhte intestinale Permeabilität kann zusätzlich zu Zonulin durch Messung von Alpha1-Antitrypsin nachgewiesen werden.
Alpha1-Antitrypsin ist ein Plasmaprotein, welches Gewebe vor der Zerstörung durch Entzündungsproteasen schützt. Es wird vor allem in der Leber gebildet. Da es sich um ein Protein mit hohem Molekulargewicht handelt, geht es nur bei erhöhter Schleimhautpermeablität (leaky gut) passiv in den Stuhl über. Erhöhte Werte sind nicht spezifisch für entzündliche Darmerkrankungen, sondern wurden bei anderen gastrointestinalen oder systemischen Erkrankungen beschrieben, die mit einer erhöhten Darmpermeabilität einhergehen.
Abb. 3 Diagnostikmarker zur Analyse der Integrität der Darmbarriere
WEITERE INFORMATIONEN
Literatur
- Dumitrescu, Laura, et al. "Serum and Fecal Markers of Intestinal Inflammation and Intestinal Barrier Permeability Are Elevated in Parkinson’s Disease." Frontiers in neuroscience 15 (2021).
- Hansson, Gunnar C., and Malin EV Johansson. "The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria." Gut microbes 1.1 (2010).
- Malíčková, Karin, et al. "Fecal zonulin is elevated in Crohn’s disease and in cigarette smokers." Practical laboratory medicine 9 (2017).
- Melhem, Hassan, Daniel Regan-Komito, and Jan Hendrik Niess. "Mucins Dynamics in Physiological and Pathological Conditions." International journal of molecular sciences 22.24 (2021).
- Rogier, Eric W., et al. "Secretory IgA is concentrated in the outer layer of colonic mucus along with gut bacteria." Pathogens 3.2 (2014).
- Singh, Prashant, et al. "Serum zonulin is elevated in IBS and correlates with stool frequency in IBS-D." United European gastroenterology journal 7.5 (2019).
- Sturgeon, Craig, and Alessio Fasano. "Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases." Tissue barriers 4.4 (2016)
- Summerton, Christopher B., et al. "Faecal calprotectin: a marker of inflammation throughout the intestinal tract." European journal of gastroenterology & hepatology 14.8 (2002).
- Vernia, Filippo, et al. "Is fecal calprotectin an accurate marker in the management of Crohn's disease?." Journal of gastroenterology and hepatology 35.3 (2020).