Kurzkettige Fettsäuren (SCFAs)
Kurzkettige Fettsäuren sind Stoffwechselprodukte, die bei der Verstoffwechslung von Ballaststoffen durch Darmbakterien entstehen. Verschiedene Bakterienspezies produzieren dabei verschiedene Fettsäuren. Wichtig scheint ein relativ stabiles Verhältnis der kurzkettigen Fettsäuren (auch SCFAs, für englisch short chain fatty acids) zu sein (ca. 60 % Acetat, je ca. 20 % Butyrat und Propionat). Eine davon stark abweichende Verteilung kann also auf eine bakterielle Dysbiose hinweisen.
Tabelle Produktion von SCFAs durch Darmbakterien
| Bakteriengattung | Acetat | Butyrat | Propionat |
|---|---|---|---|
| Akkermansia | v | v | |
| Bacteroides | v | v | V |
| Bifidobacterium | v | v | V |
| Eubacterium | v | v | v |
Faecalibacterium | v | ||
Lactobacillus | v | ||
Prevotella | v | v | v |
| Ruminococcus | v |
Verändert und ergänzt nach: Baldewijns, Silke, et al. "The role of fatty acid metabolites in vaginal health and disease: application to candidiasis." Frontiers in microbiology (2021)
SCFAs und Energiebildung
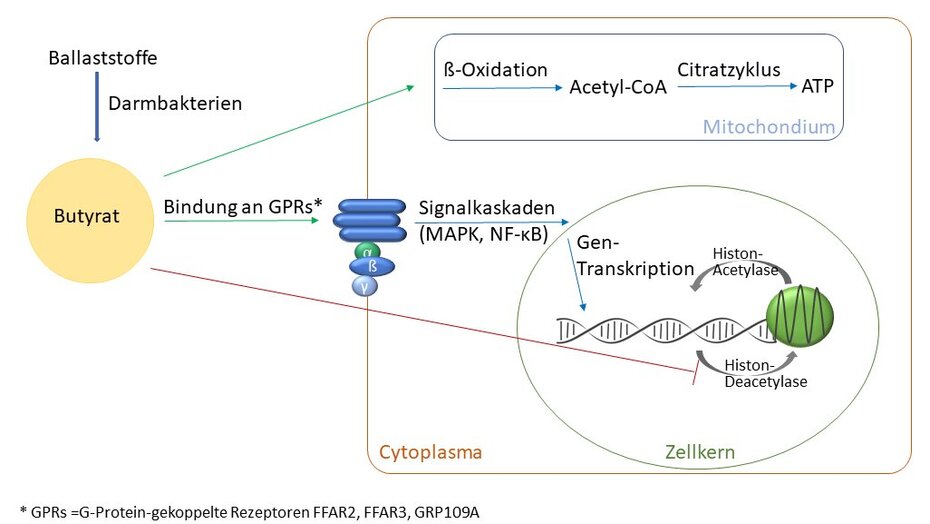
Kurzkettige Fettsäuren haben einige wichtige Funktionen innerhalb des Zellmetabolismus. Butyrat wird in die Mitochondrien der Kolonozyten transportiert und dient dort nach Oxidierung als Substrat für den Citratzyklus, über den die Zellen Energie in Form von ATP generieren (Abb.1). ATP ist für die Zellen des Darmes nicht nur essenziell, um ihre Vitalität aufrecht zu erhalten, sondern auch für aktive Transport- und Resorptionsprozesse von Nahrungsbestandteilen, inklusive Vitamine und Mineralstoffe.
SCFAs und Genexpression
SCFAs sind Effektormoleküle sogenannter G-Protein-gekoppelter Rezeptoren, deren Aktivierung vielfältige Signalkaskaden, darunter MAP-Kinase-Signalwege initiieren kann. Am Ende solcher Signalwege stehen häufig Transkriptionsfaktoren, wie NF-κB, welche die Expression von Genen regulieren. Die Genexpression kann zusätzlich durch die Eigenschaft von Butyrat als Histondeacetylase-Hemmer beeinflusst werden. Die Acetylierung der Histonproteine ist wichtig, um die enge Packung der DNA in Form der Chromosomen zu lockern und die Transkription von Genen zu ermöglichen. Deacetylierung wirkt dem entgegen. Die Hemmung der deacetylierenden Enzyme durch Butyrat kann also die Genexpression fördern (Abb. 1).
SCFAs und die Darmbarriere
In einer Studie aus dem Jahr 2021 konnte anhand von Kolonozyten-Zelllinien gezeigt werden, dass proinflammatorische Zytokine die Expression von Proteinen der Zonula Occludens, besser bekannt als Tight Junctions, beeinflussen. Die Inkubation des einschichtigen Zellverbunds mit den Zytokinen TNF-α, IFN-γ, oder IL-13 resultierte in einer spezifischen Überexpression von Claudin-2, einem porenbildenden Protein innerhalb der Zonula Occludens. Diese Überexpression ging mit einer erhöhten Permeabilität der Zellschicht einher. Die Zugabe von Butyrat, jedoch nicht die anderer SCFAs, schwächte die durch TNF-α/IFN-γ oder IL-13 induzierte Permeabilitäts-steigerung und Hochregulierung von Claudin-2 ab. Die Ergebnisse deuten darauf hin, dass speziell Butyrat wesentlich zur Linderung einer gestörten Darmbarriere beitragen kann und Claudin-2 das Hauptziel dieser Fettsäure ist.
Die kurzkettigen Fettsäuren haben jedoch auch einen direkten Einfluss auf die Bildung pro- und antientzündlicher Zytokine. Durch Bindung und Aktivierung von GPRs auf verschiedenen Klassen von Immunzellen werden diese zur Bildung antientzündlicher Zytokine angeregt, die wiederum die Bildung toleranzinduzierender regulatorischer T-Zellen (Treg-Zellen) fördern.
SCFAs und das Gehirn
Es ist bekannt, dass proinflammatorische Zytokine in der Blutzirkulation einen Einfluss auf die Gehirnaktivität haben können, unsere Stimmung beeinflussen und depressive Zustände auslösen können. Nicht nur über diesen Weg wird die Beeinflussung kognitiver Prozesse durch SCFAs postuliert. Auch die durch Aktivierung G-Protein-gekoppelter Rezeptoren auf den Darmepithelzellen vermehrt ausgeschütteten Peptidhormone oder die direkte Interaktion mit Nervenzellen beeinflussen Prozesse im ZNS.
Eine aktuelle Studie an diabetischen Mäusen hat gezeigt, dass die durch Depletion actetatbildender Bakterien kognitiven Störungen durch Gabe von Acetat und dessen Interaktion mit Afferenten des Vagusnervs im Darm die Gedächtnis- und Lernleistung der Mäuse wiederherstellen konnte.
Die Messung der SCFAs im Stuhl kann direkt oder indirekt über die Mengen von Darmbakterien, welche SCFAs produzieren, erfolgen. Im Serum können die systemisch wirksamen Anteile gemessen werden.
Indikationen für die Analyse von „SCFA im Stuhl“
- Entzündung des Darmepithels
- Gesteigerte Darmpermeabilität
- V.a. Dysbiose z.B. nach Antibiotikagabe
- Im Rahmen der Allergieprävention bei Kleinkindern mit Atopieneigung
- Ernährung mit geringem Anteil an Ballaststoffen
Indikationen für die Analyse von „SCFA im Serum“
- Chronische Entzündung
- Leaky gut-Syndrom
- Entzündliche Darmerkrankungen
- Störungen des Glukose- oder Lipidstoffwechsels
- Übergewicht und Störungen der Appetitregulation
- Depressive Symptomatiken
- Neurodegenerative Erkrankungen
Literatur
- Dalile, Boushra, et al. "The role of short-chain fatty acids in microbiota–gut–brain communication." Nature reviews Gastroenterology & hepatology 16.8 (2019).
- Donohoe, Dallas R., et al. "The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon." Cell metabolism 13.5 (2011).
- Huang, Xinyi, et al. "Butyrate alleviates cytokine-induced barrier dysfunction by modifying claudin-2 levels." Biology 10.3 (2021).
- Priyadarshini, Medha, et al. "Role of short chain fatty acid receptors in intestinal physiology and pathophysiology." Comprehensive Physiology 8.3 (2018)
- van der Hee, Bart, and Jerry M. Wells. "Microbial regulation of host physiology by short-chain fatty acids." Trends in Microbiology 29.8 (2021).
- Zheng, Hong, et al. "Depletion of acetate-producing bacteria from the gut microbiota facilitates cognitive impairment through the gut-brain neural mechanism in diabetic mice." Microbiome 9.1 (2021).




