Autoimmundiagnostik
Die Autoimmundiagnostik umfasst neben allgemeinen Entzündungsparametern eine gezielte Bestimmung von Autoantikörpern (AAk), die, wenn möglich, immer aus klinisch diagnostischen Gesichtspunkten (z.B. Organzuordnung) hergeleitet sein sollte. Zusätzlich ist bei einigen Autoimmunerkrankungen die Bestimmung typischer, damit assoziierter HLA-Allele differentialdiagnostisch anwendbar.
Autoantikörper haben einen hohen Stellenwert in der Diagnostik von Autoimmunerkrankungen, da sie eine vielseitige klinische Relevanz haben. Sie können als diagnostische, prädiktive, prognostische und/oder als Aktivitäts-Marker herangezogen werden. Viele Studien zeigten, dass ein frühzeitiger und umfänglicher Autoantikörper-Suchtest entscheidend ist für die rechtzeitige Erkennung, Diagnose und Therapie von Autoimmunerkrankungen.
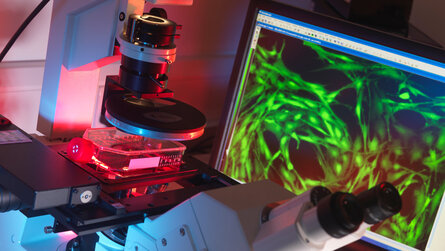
Zu unserem etablierten Methodenspektrum gehört die Immunofluoreszenztechnik (IFT), die weltweit zu den bewährten und empfohlenen Methoden im Rahmen eines Autoantikörper-Screenings gehört. Die IFT wird in unserem Labor durch speziell geschultes und langjährig erfahrenes Personal durchgeführt. Neben der IFT bieten wir selbstverständlich auch Enzymimmunoassays (ELISA) und Lineassays zur AAk-Differenzierung an:
Die IFT ist ein häufig verwendeter mikroskopischer Test zum Nachweis von Autoantikörpern (AAk) im Patientenserum. Die AAk richten sich gegen bestimmte Antigene von Zellen oder Geweben. Der Test basiert auf histologischen Präparaten (Zellkulturen oder Gewebeschnitte, wie z.B. Rattenleber), die auf einem Objektträger aufgebracht wurden. Im Labor wird das zu untersuchende Patientenserum auf das entsprechende Präparat gegeben. Bei Patientenproben, welche den nachzuweisenden AAk enthalten, binden sich diese an die auf dem Objektträger aufgebrachten Zell- bzw. Gewebeantigene. Nicht-gebundene Antikörper werden durch Waschschritte entfernt. Um die gebundenen AAk zu identifizieren und zu beurteilen, müssen sie für die Fluoreszenzmikroskopie sichtbar gemacht werden. Das erfolgt durch die Zugabe eines Fluorochrom-markierten Anti-Human-Antikörpers. Jeder gebundene AAk zeigt ein typisches Fluoreszenzmuster, je nach Lokalisation der einzelnen Antigene. Für eine Konzentrationsangabe der AAk werden die positiven Proben stufenweise verdünnt (austitriert) und im Befund mit dem Endtiter angegeben (z.B. 1:320).
Der Vorteil der IFT im Vergleich zum ELISA besteht in dem breiten Antigenspektrum der Ausgangssubstrate in ein und demselben Analyseansatz. Auf diese Weise können eine Vielzahl von verschiedenen Antikörperspezifitäten erfasst und eine hohe Trefferquote erzielt werden.
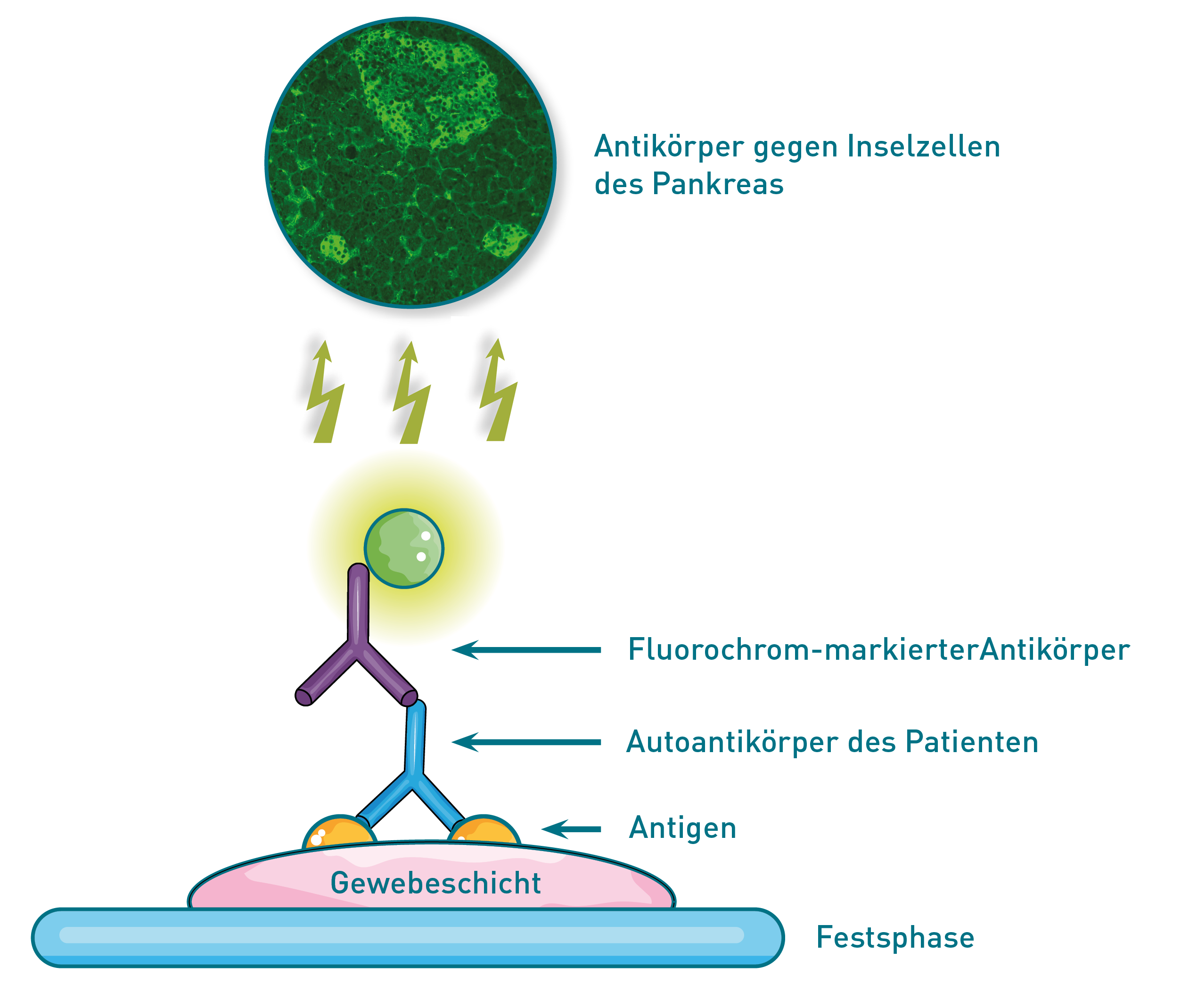
Mit dem immunologischen Nachweisverfahren ELISA (Enzyme-linked immunosorbent-assay) können Autoantikörper (AAk) semiquantitativ und quantitativ nachgewiesen werden. Bei semiquantitativen Tests wird ein Antigengemisch verwendet. Daher muss bei positiven Ergebnissen anschließend die Antikörperspezifität durch einen monospezifischen Test untersucht werden.
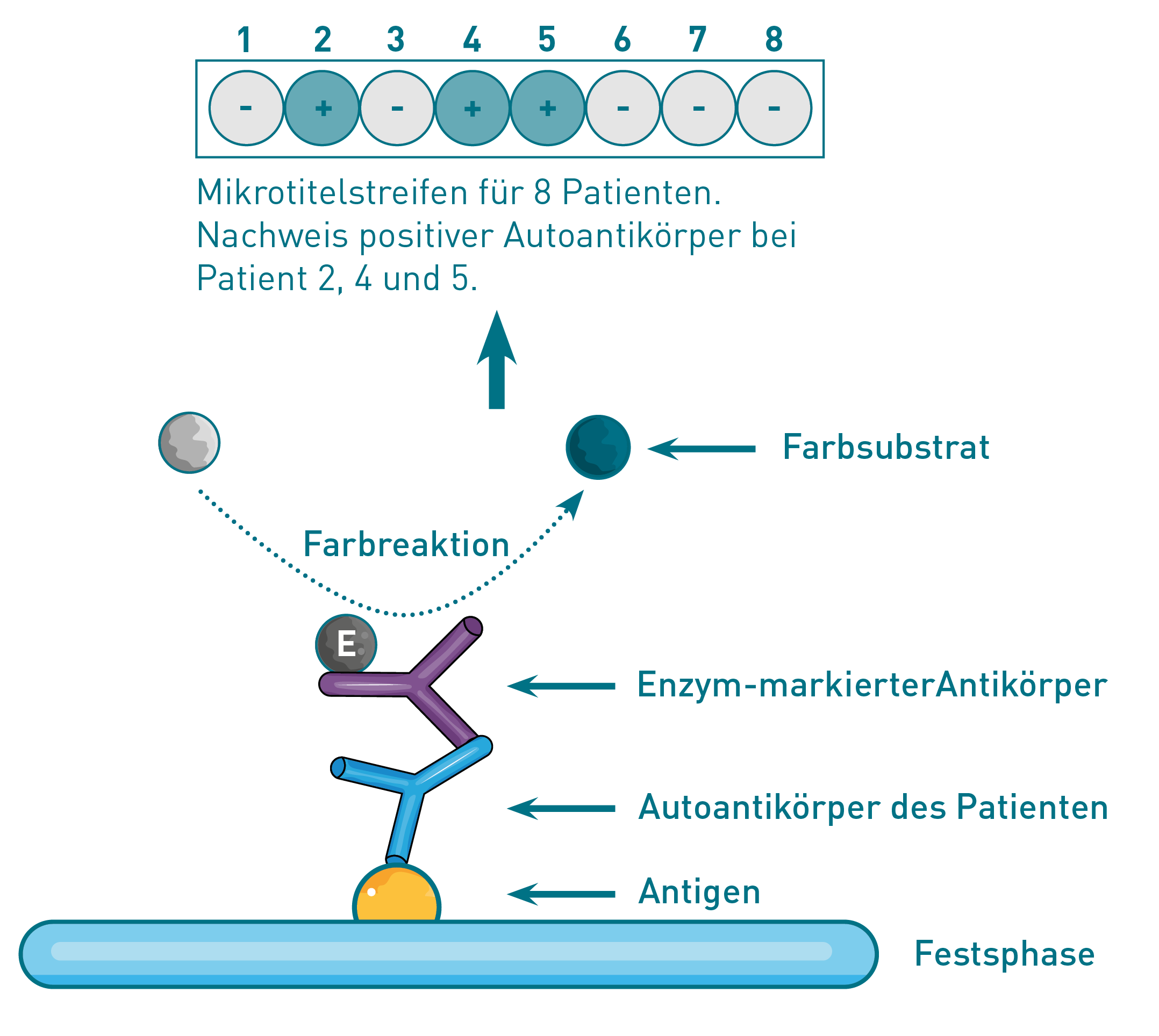
Wie aus der Bezeichnung „ELISA“ hervorgeht, ist eine Komponente (in diesem Fall das Antigen) an einer festen Phase adsorbiert und der Sekundär-Ak enzymatisch markiert. Positive AAk im Untersuchungsmaterial (z.B. Serum) binden an das Festphase-gebundene Antigen. Nicht-gebundene Antikörper werden durch Waschschritte entfernt. In der darauf folgenden Inkubation bindet der Sekundär-Ak spezifisch an die nachzuweisenden Patienten-AAk. Über das an den Sekundär-Ak gekoppelte Enzym wird eine Substratreaktion ausgelöst, die zu einer messbaren Farbänderung führt. Die photometrisch gemessene Färbung korreliert mit der Konzentration der gebundenen Antikörper.
Der RIA (Radioimmunassay) gehört auch zu den Immunassay-Verfahren, basiert aber im Unterschied zum ELISA nicht auf einer enzymatischen Farbreaktion, sondern auf einer Quantifizierung der radioaktiv-markierten Sekundärantikörper.
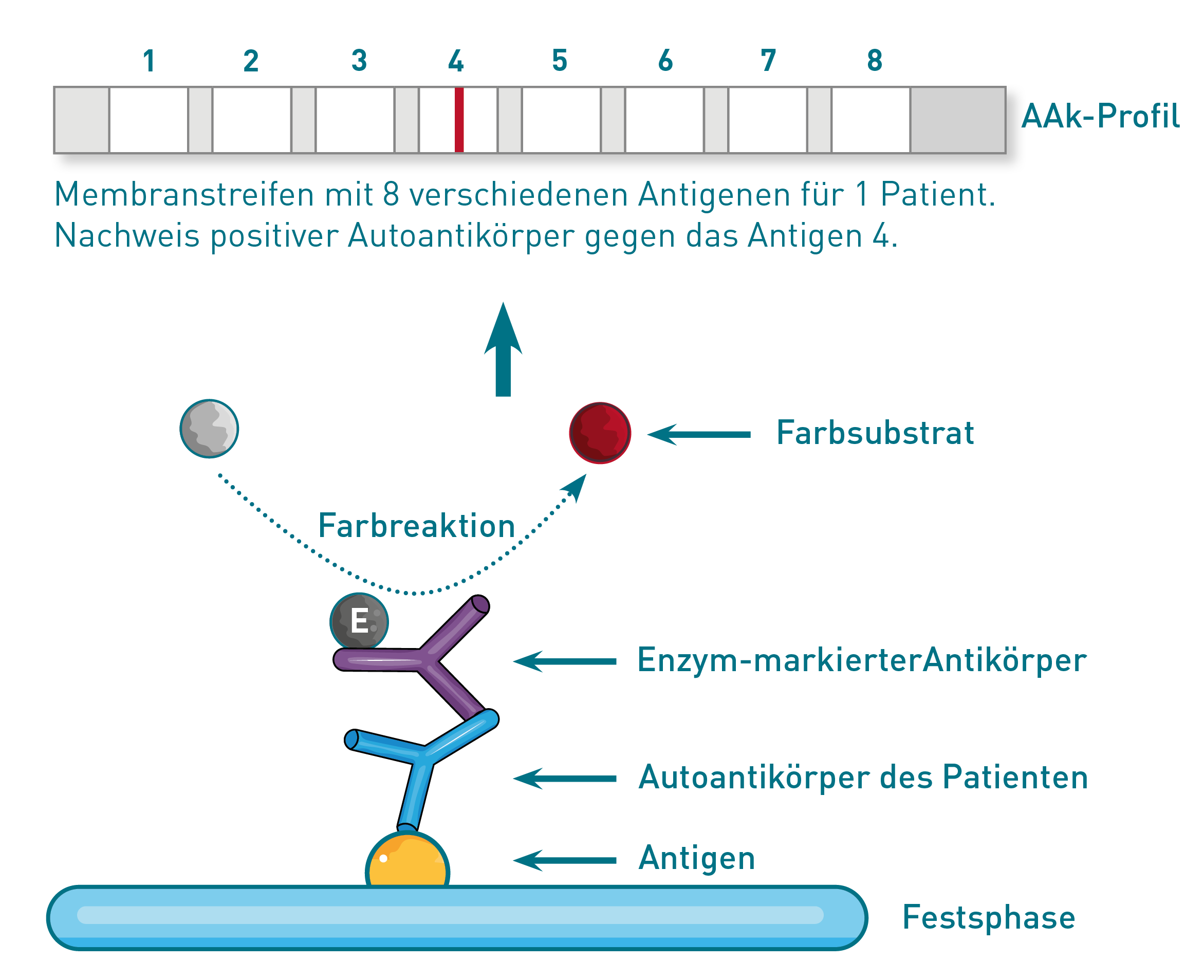
Der Immunoblot/Lineassay dient in der Autoimmundiagnostik ebenfalls dem Nachweis von Autoantikörpern (AAk) über eine Antigen-Antikörper-Interaktion. Ähnlich dem ELISA werden hier die spezifischen Antigene auf eine Festphase aufgetragen. Als Festphase dient in diesem Fall ein Membranstreifen, auf den das zu untersuchende Patientenserum aufgebracht wird. Bei positiven Patientenproben binden die nachzuweisenden AAk spezifisch an die Festphasen-gebundenen Antigene. Zur Visualisierung der gebundenen Patienten-AAk wird ein Sekundär-Ak benutzt, der wie beim ELISA mit einem Enzym gekoppelt ist. Über das Enzym wird eine Farbreaktion ausgelöst, die als positives Signal auf dem Membranstreifen erscheint. Das heißt, wenn spezifische Antikörper im Serum des Patienten vorhanden sind, erscheint eine dunkle Linie an der jeweiligen Antigen-Position. Der Vorteil von Immunoblots/Lineassays ist die gleichzeitige Analyse mehrerer Antikörper simultan in ein und demselben Testansatz. Der Nachteil zum ELISA ist die in der Regel fehlende Möglichkeit der exakten Quantifizierung der Antikörper (meist nur qualitative Aussage).
Da jede Autoimmunerkrankung ihr eigenes, spezielles Autoantikörper-Profil aufweist, haben wir für Sie spezielle Anforderungsblöcke mit allen gängigen Autoantikörpern zusammengestellt. Sie sollen aufgrund ihrer diagnostischen Wertigkeit als ein Leitfaden für eine effiziente Autoimmundiagnostik dienen. Die Einteilung erfolgt hier nach organspezifischen und systemischen Erkrankungen, auch wenn es bei den 2 Gruppierungen gewisse Überschneidungen gibt.
Organspezifische Autoimmunerkrankungen
Systemische Autoimmunerkrankungen
Probenmaterial für die Bestimmung von Autoantikörpern
1 ml Serum oder Vollblut
Das Probenmaterial ist stabil bei Raumtemperatur, der Transport ins Labor ist unproblematisch und kann auch per Postversand erfolgen.
Abrechnung
Eine Abrechnung im kassen- und privatärztlichen Bereich ist gegeben. Bei Kollagenosen unter immunsuppressiver oder immunmodulierender Langzeit-Basistherapie sind die Laborleistungen nach Abschnitt 32.2 budgetbefreit nach Ziffer 32023. Im kassenärztlichen Bereich gilt für die Untersuchung von Autoantikörpern ein Höchstwert, der die Bestimmung von ca. 5 Analysen ermöglicht.